Entalpia
A energia da ligação química, ou o calor de uma ligação química, é dada pela grandeza Entalpia (H). Quando ligações são feitas ou desfeitas há variação na energia dessas ligações expressa pela variação de entalpia (ΔH) - a variação negativa indica um processo exotérmico (liberação de calor) e a variação positiva um processo endotérmico (absorção de calor).
Entropia
A entropia é um parâmetro associado ao grau de desordem de um sistema, ou seja, quanto maior a desordem de seus componentes maior a entropia desse sistema. Se um sistema ordenado passa a apresentar desordem sua variação de entropia (ΔS) é positiva, enquanto que a organização torna o ΔS negativo. A entropia em um sistema será a maior possível dentro das limitações desse sistema.
A Equação de Boltzmann define matematicamente a entropia como
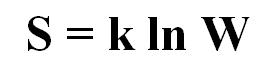
onde k é a constante de Boltzmann e W é igual ao número de microestados do sistema, ou seja, de todas suas configurações possíveis.
Energia Livre
Em um equilíbrio, a variação de energia livre é dada por:
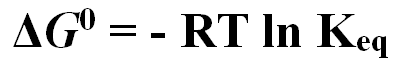
Neste equilíbrio, a formação de produtos é favorecida (espontânea) pela variação negativa de energia livre (ΔG < 0, exergônica). Se a variação for positiva (ΔG > 0, endergônica) a formação de produtos não será espontânea e só ocorrerá se houver fornecimento da energia necessária. Se ΔG = 0 a reação alcançou o equilíbrio
A variação de energia livre de Gibbs pode ser descrita pelos componentes da variação de entalpia e de entropia:
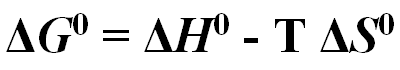
Se houver diminuição da energia de produtos em relação aos reagentes (ΔH0 negativo) e aumento na desordem dos produtos em relação aos reagentes (ΔS0 positivo, - TΔS0 negativo) a variação da energia livre será negativa e a reação será espontânea em direção aos produtos.
Exceto pelas reações a altas temperaturas, o termo - TΔS0 é pequeno e em geral contribui pouco para a espontaneidade da reação. Assim, a entalpia é o parâmetro de maior peso na determinação da direção da reação - reações exotérmicas tendem a ser favorecidas no equilíbrio enquanto que reações endotérmicas tendem a ser desfavorecidas.
A variação de energia livre de Gibbs (ΔG0) é um parâmetro termodinâmico, ou seja, ele indica se um processo pode ocorrer espontaneamente no equilíbrio a partir das energias iniciais e finais, mas não fornece qualquer informação sobre como o processo ocorre ou sobre a taxa em que ocorre.
