Os carácteres eletrofílicos e nucleofílicos das espécies podem ser explorados para fazer ligações químicas, sendo as reações de substituição as principais.
As reações de substituição estão divididas basicamente em duas categorias: de 1º ordem e de 2º ordem.
A Substituição Nucleofílica de 1º ordem (SN1) ocorre quando só há uma molécula durante a etapa lenta e, por isso, é a etapa em que há formação de cargas. Essas cargas precisam ser devidamente estabilizadas pela própria estrutura - terciários reagem bem por SN1 enquanto primários quase não reagem - e pelo solvente - solventes polares próticos favorecem essa reação.
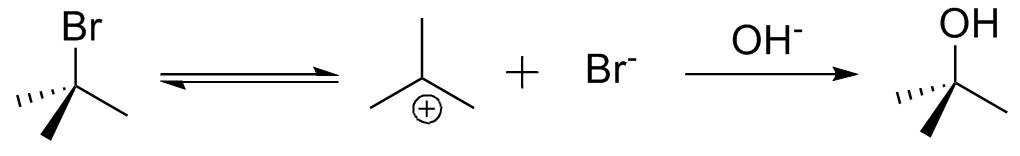
Na Substituição Nucleofílica de 2º ordem (SN2) duas moléculas participam da etapa lenta num ataque concertado, ou seja, não há formação de cargas. Por esse motivo não há necessidade de estabilização adicional e as reações podem ocorrer em solventes polares apróticos ou apolares e primários reagem bem por essa via. Terciários não reagem por conta do impedimento estérico causado no nucleófilo.
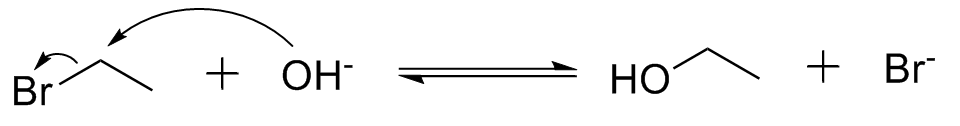
Uma consequência importante disso é que reações de um enantiômero puro por SN1 geralmente leva à mistura racêmica, enquanto que a reação por SN2 geralmente leva à inversão de configuração.
Substituição Nucleofílica com Heteroátomos
Heteorátomos como nitrogênio ou oxigênio tem pares de elétrons livres que os tornam tanto bases de Lewis quanto bons nucleófilos. Dessa forma, aminas e álcoois podem fazer reações de substituição nucleofílicas em moléculas com bons grupos de saída.
A reatividade do nucleófilo aumenta muito se este estiver como ânion: fenóxidos são muito mais nucleofílicos do que fenóis, haletos e cianeto são nucleofílicos enquanto que haletos de alquila e nitrila praticamente não reagem.
A maior facilidade em formar ligação também facilitar as reações no sentido contrário, assim, a maioria das substituições com heteroátomos estão suscetíveis a quebra em condições relativamente suaves.
Substituição Nucleofílica com Carbânions
Quanto maior a sobreposição orbitalar e o caráter covalente de uma ligação, mais difícil será para rompê-la. A Ligação carbono-carbono é muito resistentes à quebra e é a melhor escolha para aumento de cadeia.
Devido à sua baixa eletronegatividade o carbono pode se tornar facilmente eletrofílico, mas para ser nucleofílico é necessário que esteja ligado a um átomo pouquíssimo eletronegativo - em geral, metais.
Uma possibilidade é formar organolítios:
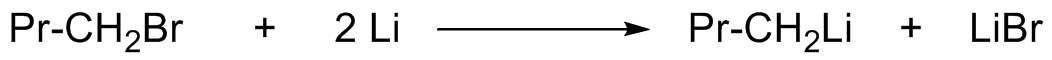
Organolítios são muito reativos e, dependendo do sistema, pode ser difícil controlar a competição entre sua nucleofilicidade e sua fortíssima basicidade.
Outra possibilidade é formar os chamados Reagentes de Grignard:
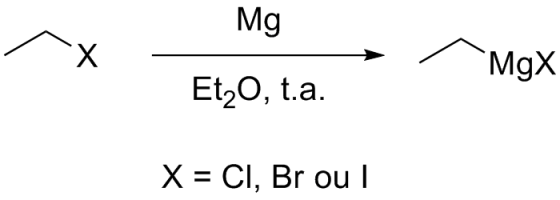
A vantagem do uso de Reagente de Grignard é que são bases muito mais fracas do que os organolítios. Numa reação com cetonas, um Reagente de Grignard fará o ataque nucleofílico enquanto que o organolítio tenderá a desprotonar o H α-cetona.
