Reações do Grupo -OH
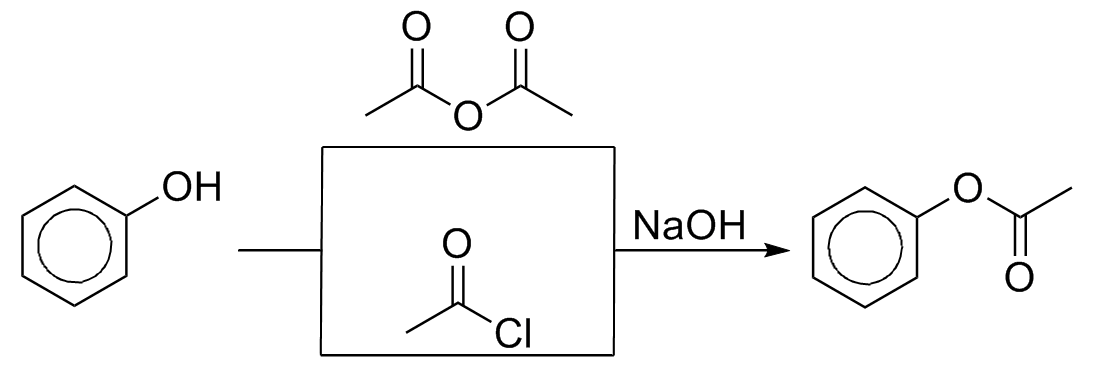
Fenois podem formar ésteres ao reagir com anidridos ou cloretos de ácidos em meio básico:
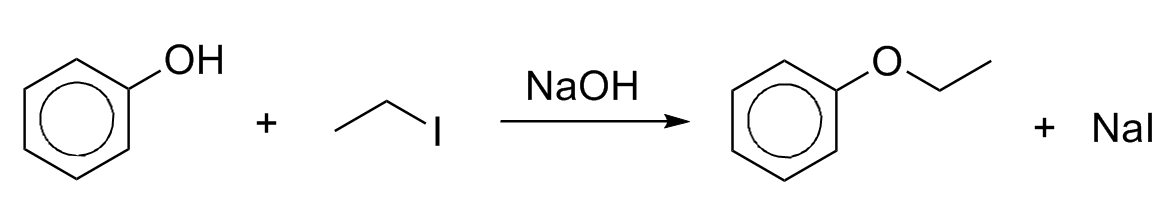
Também podem formar éteres por substituição nucleofílica (Síntese de Williamson):
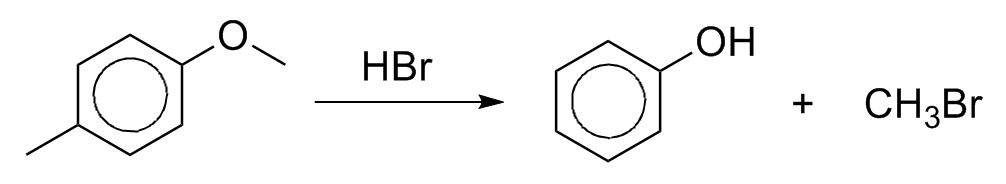
Éteres alquilarilas sofrem clivagem sob ação de um ácido forte como HBR ou HI para formar um fenol e haleto de alquila.
Reações no Anel Aromático
Várias reações se utilizam da capacidade do grupo hidroxila no fenol em ativar fortemente reações de substituição eletrofílica aromática. A bromação ocorre prontamente pelo uso de Br2 a temperatura ambiente e leva à polibromação em água. A monobromação pode ser obtida a frio em dissulfeto de carbono.
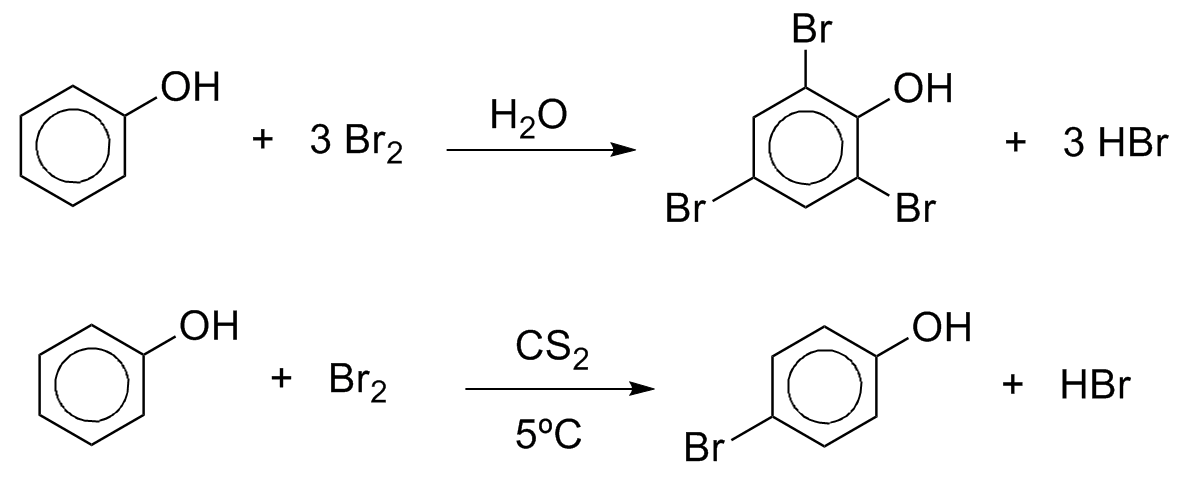
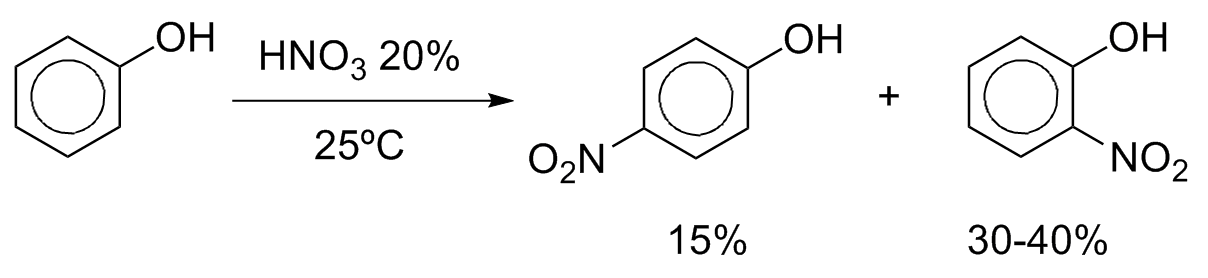
A nitração também ocorre prontamente a temperatura ambiente com HNO3 diluído para formar uma mistura de orto e p-nitrofenois e ooutros produtos de oxidação do anel aromático.
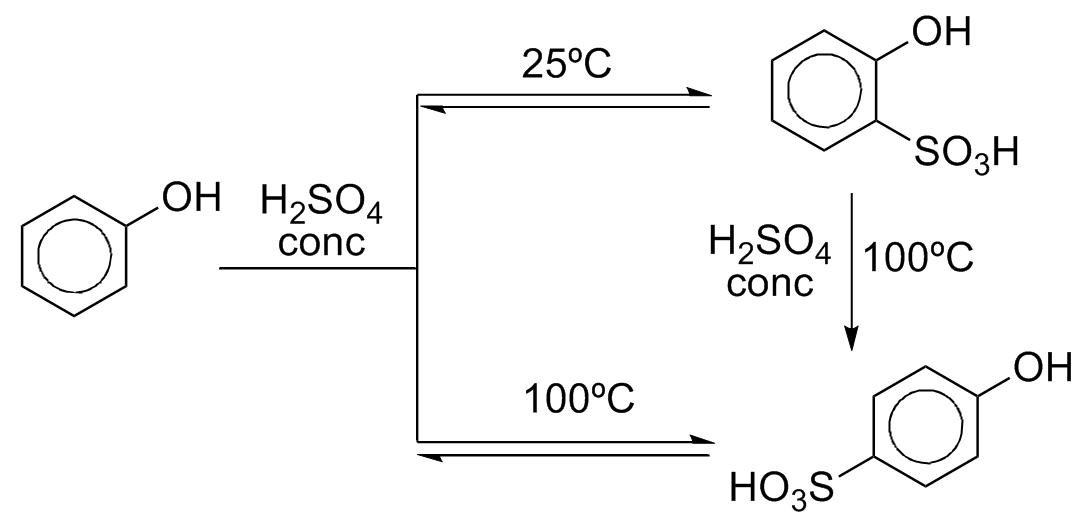
A sulfonação pode ser feita a temperatura ambiente para gerar ácido o-hidroxissulfônico via controle cinético ou o ácido p-hidroxissulfônico via controle termodinâmico. O ácido o-hidroxissulfônico pode ainda ser interconvertido no isômero para a 100ºC.
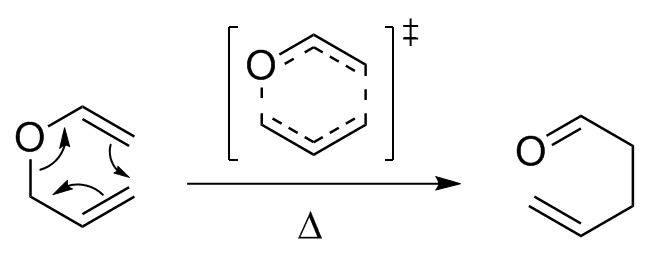
Rearranjo de Claisen
Se um éter alil fenílico for aquecido a 200ºC ocorre uma rearranjo concertado (reação pericíclica) para formar o o-alilfenol:
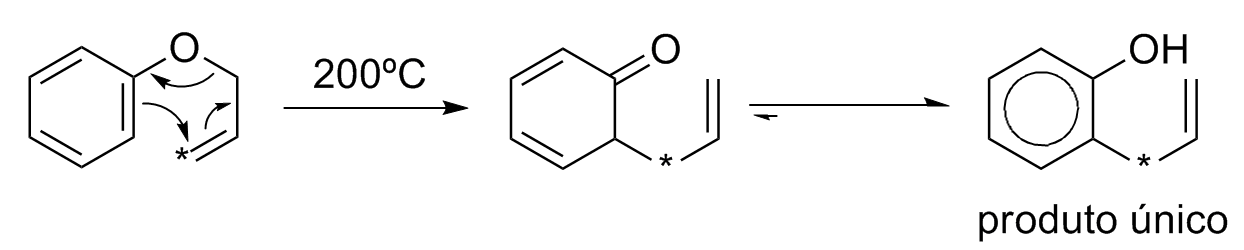
A análise da reação com marcação do metileno vinílico indica a necessidade de um mecanismo concertado para explicar o produto obtido.
O rearranjo de Claisen também ocorre em éteres alil vinílicos: