Ligação Química
A ligação química ocorre quando dois orbitais semipreenchidos são sobrepostos formando uma interseção intraorbitalar em que os elétrons dos dois orbitais estão emparelhados. A força da ligação é diretamente proporcional ao volume da sobreposição (V na figura), logo quanto maior a sobreposição menor será o comprimento da ligação (distância internuclear, d).
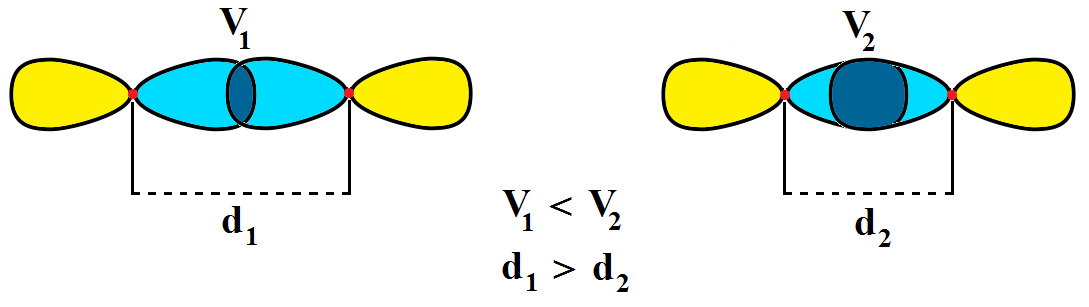
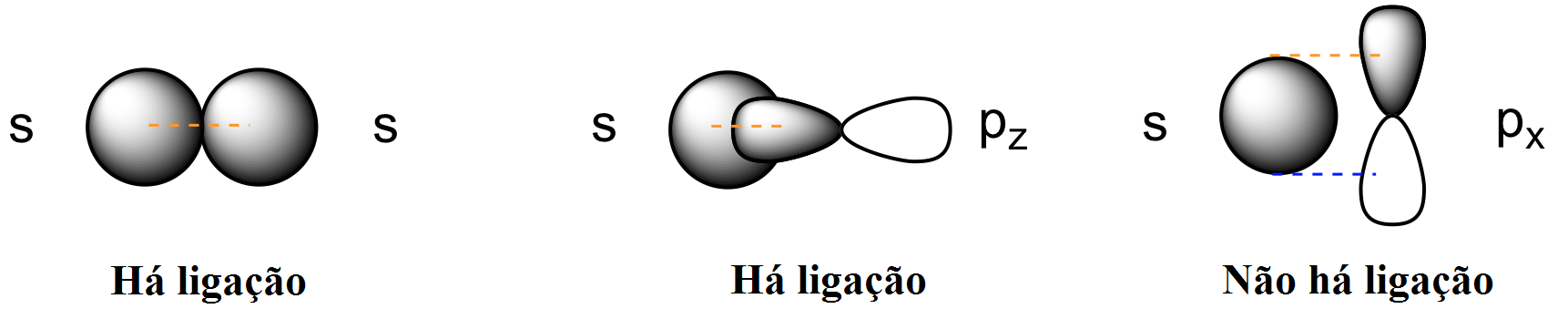
Tipos de Ligação Química
Há ao menos três tipos de ligações químicas: a ligação σ, a ligação π e a ligação δ (não abordada nesse curso).
A ligação σ ocorre quando há sobreposição frontal dos orbitais ligantes sobre o eixo da ligação e ocorre entre orbitais s e/ ou orbitais hibridizados (ver Hibridização).
A ligação π ocorre quando há sobreposição lateral dos orbitais ligantes paralelamente ao eixo da ligação e ocorre entre orbitais p de mesma fase.
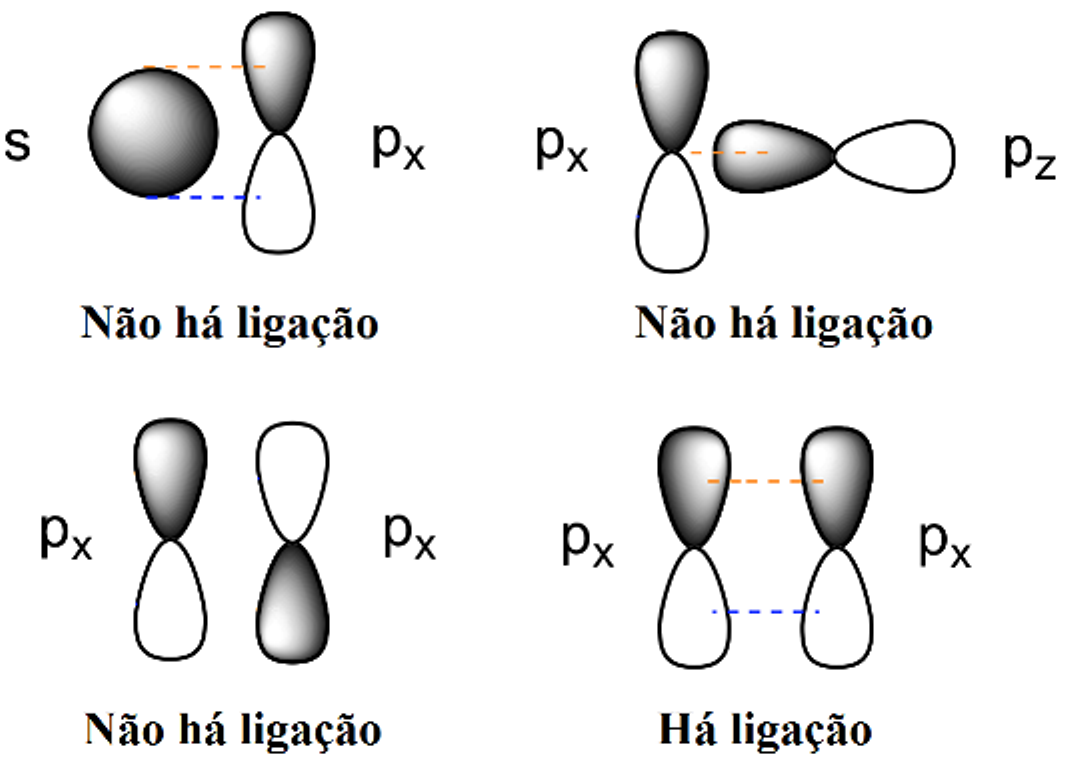
Como sempre ocorrem entre elétrons desemparelhados da camada de valência, é possível prever a ordem de ligação para os elementos representativos baseado na regra do octeto: cada H (1s1) formará uma ligação σ com o O (1s2 2s2 2p4) para formar H2O.
