O Caso do Carbono
Apesar de fornecer importantes informações sobre as ligações químicas, a Teoria da Ligação de Valência costuma falhar no elemento mais importante para a Química Orgânica: o carbono. A distribuição do carbono (1s2 2s2 2p2) sugere que ele faça apenas duas ligações, já que tem dois elétrons desemparelhados e um orbital vazio, mas em grande parte dos compostos o carbono faz quatro ligações. Para contornar essa incoerência, algumas adaptações foram introduzidas.
Como o elétron pode ser tratado como onda a ligação química pode ser encarada matematicamente como uma interação construtiva entre duas funções de onda de dois orbitais com elétrons desemparelhados. Os orbitais do átomo também podem ser recombinados matematicamente para formar funções de onda híbridas, também chamados de orbitais hibridizados.
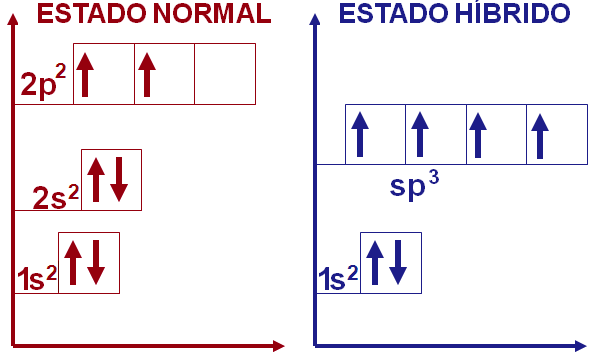
Hibridização sp3
Para que o resultado final seja energicamente favorável são utilizados o orbital 2s e os três 2p, totalizando quatro orbitais, para formar o orbital híbrido sp3. Apesar do orbital s ter sua energia elevada no orbital sp3, a diminuição nos três orbitais p é favorável no conjunto. Dessa forma, o orbital sp3 é capaz de explicar satisfatoriamente a química do carbono com quatro ligações σ.
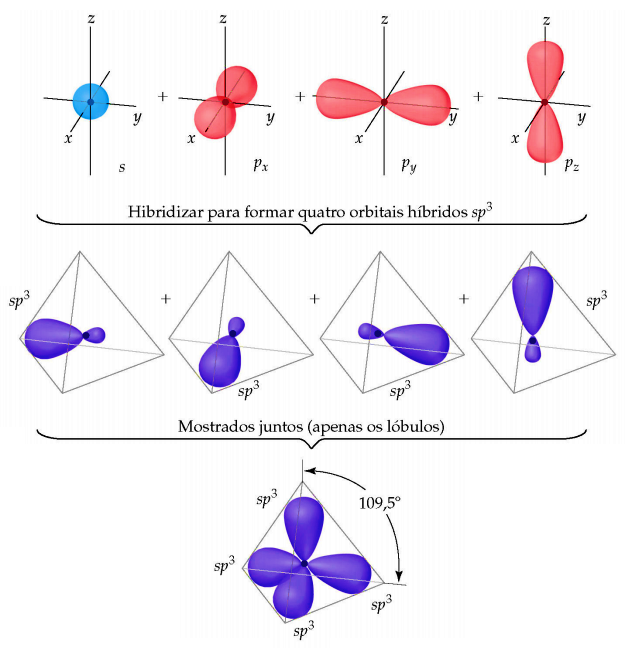
Durante o processo de hibridização o formato dos orbitais também é alterado, inferindo assim a geometria das moléculas sob esse arranjo. O formato do orbital sp3 é tetraédrico e o ângulo entre seus orbitais é de 109,5º, o maior possível para manter a máxima distância entre eles. De fato, os compostos que o carbono forma com quatro ligações σ, como o metano (CH4), possuem geometria tetraédrica.
Hibridização sp2
O carbono também pode formar ligações π. Para permitir esse tipo de ligação basta hibridizar o orbital 2s com um orbital 2p desemparelhado e o orbital 2p vazio para formar o orbital híbrido sp2. O orbital sp2 fará assim três ligações σ, restando ao orbital p não hibridizado formar uma ligação π.
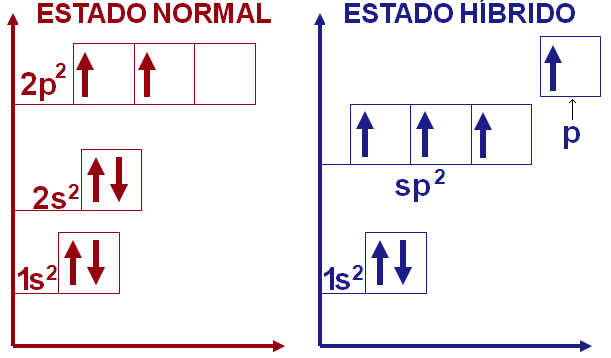
Novamente, a geometria do orbital hibridizado será diferente da dos originais. No orbital sp2 há um plano triangular onde ocorrem as ligações σ e o ângulo entre seus orbitais é de 120º, enquanto o orbital p mantém seus lobos fora desse plano em ângulo de 90º.

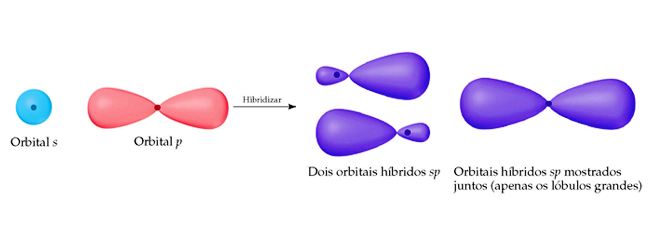
Hibridização sp
Existem ainda alguns compostos de carbono que fazem duas ligações π, o que poderia ser explicado pela hibridização entre um orbital 2s e o orbital vazio 2p para formar o orbital hibridizado sp. Esse orbital hibridizado forma as duas ligações σ enquanto os dois orbitais p não hibridizados formam as outras duas ligações π.
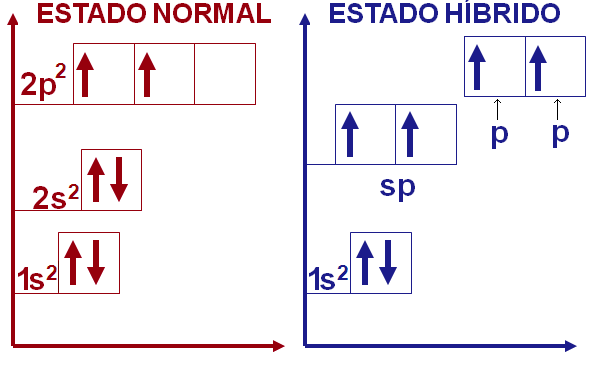
Para manter a máxima distância entre os orbitais hibridizados seu ângulo deve ser de 180º, enquanto que os orbitais p restantes ocupam as demais coordenadas tridimensionais disponíveis, tornado sua geometria linear.
Dessa maneira as quatro ligações que o carbono faz e a geometria de seus vários compostos pode ser explicada e prevista. Esse tratamento também pode ser aplicado a todos os demais elementos como o oxigênio, nitrogênio e enxofre, por exemplo, com aplicação importante na explicação dos compostos que não seguem a regra do octeto.
