Interação de Orbitais Atômicos
A ligação química entre orbitais atômicos segue a mesma lógica da hibridização: suas funções de onda são combinadas matematicamente para formar orbitais novos - os orbitais moleculares (OM). A cada par de orbitais atômicos será formado um par de orbitais moleculares: um orbital ligante (com mesma fase, favorece a ligação e possui baixa energia) e um orbital antiligante (com fases opostas, desfavorece a ligação e possui alta energia). O orbital atômico que eventualmente não participa da combinação se torna um orbital não ligante (efeito neutro na estabilidade da ligação química).
O termo orbital molecular significa que esses orbitais não estão localizados em nenhum lugar particular nos átomos participantes, mas em toda a molécula. Para ilustrar pode-se tomar o caso da molécula de H2:
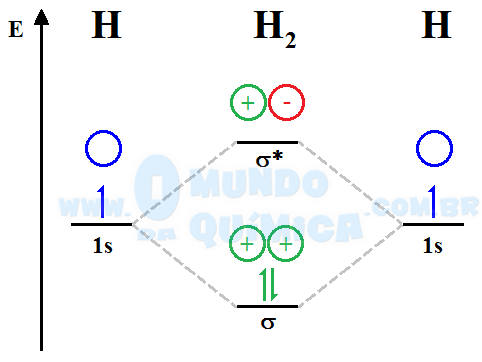
Os dois elétrons dos orbitais atômicos passaram a ocupar um orbital molecular ligante (σ), que possui menor energia do que os orbitais atômicos. Dessa maneira, a ligação química é mais estável do que os átomos isolados e a formação da molécula é favorecida. O preenchimento dos OM segue o mesmo princípio dos orbitais atômicos: sempre da menor para maior energia (Princípio da construção), com preenchimento dos spins desemparelhados antes de emparelhá-los em orbitais de mesma energia (Regra de Hund) e respeitando o limite de 2 elétrons emparelhados (spins contrários) por orbital (Princípio da Exclusão de Pauli).
Ordem de Ligação
A Teoria dos OM permite avaliar, dentre muitas outras coisas, a viabilidade de uma ligação química. A análise da molécula de He2 ilustra sua capacidade em prever ligações químicas:
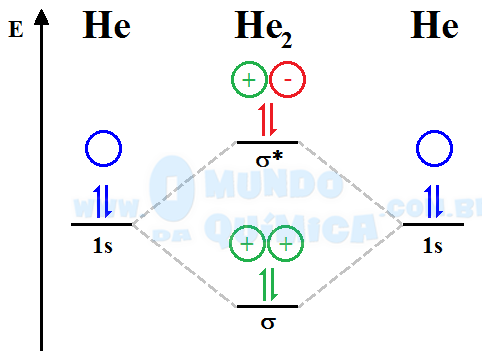
Na molécula de He2 os elétrons foram distribuídos igualmente entre os orbitais ligante e antiligante, de modo que o ganho de energia no ligante é perdido ao preencher o antiligante. Assim, a molécula de He2 não é estável e não deve ser formada.
Após a formação bem sucedida de uma ligação química a densidade eletrônica aumenta entre os núcleos no OM ligante, enquanto que no OM antiligante ocorre um nó (densidade eletrônica nula) e baixa densidade eletrônica internuclear.
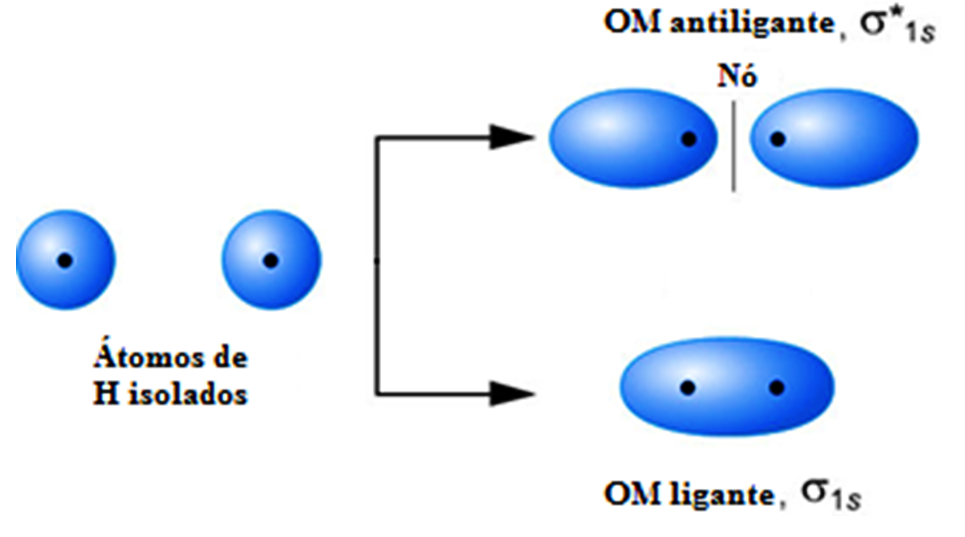
Em átomos idênticos, como no H2, a densidade eletrônica fica simetricamente distribuída, mas em átomos diferentes essa distribuição pode tender a um dos núcleos.
