Força da Ligação
Quanto menor for a sobreposição orbitalar entre o hidrogênio e o heteroátomo menor será a energia da ligação, tornando-a mais fácil de ser quebrada. Isso desloca o equilíbrio para a formação de H+ elevando assim o valor de Ka e a acidez da substância.
Para a série dos halogênios e calcogênios o valor do pKa diminui (a acidez aumenta) quanto maior é o raio do hetereoátomo:

Efeito Indutivo
Quanto maior for a diferença de eletronegatividade entre o hidrogênio e o heteroátomo menor será a força da ligação e, consequentemente, maior será a acidez. Para o segundo período é observado um aumento muito rápido na acidez em função das diferentes eletronegatividades:
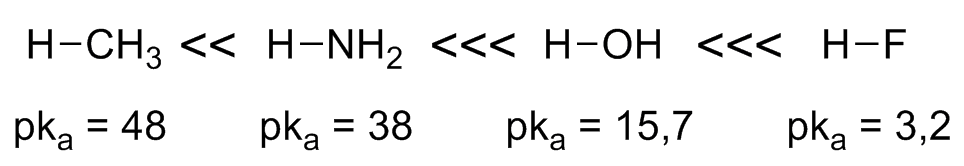
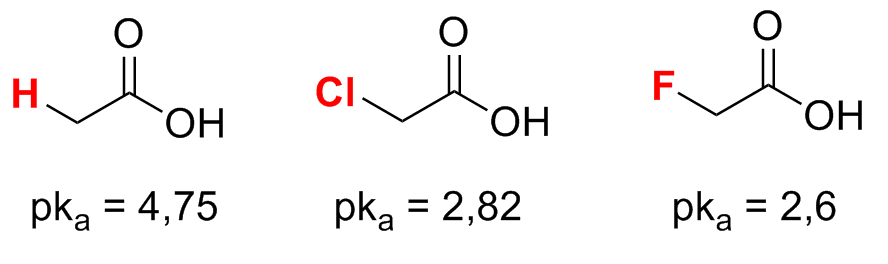
Grupos que exercem efeito indutivo também podem acentuar a acidez de ácidos carboxílicos:
Estabilidade da Base Conjugada
Após a quebra da ligação para formar o próton, o equilíbrio será mantido neste sentido quanto mais estável a base conjugada for. Os efeitos possíveis de estabilização são o efeito indutivo (via eletronegatividade), o espalhamento de carga por raio iônico grande ou por ressonância. A série dos halogênios e calcogênios demonstram o efeito do raio para a estabilização da carga:

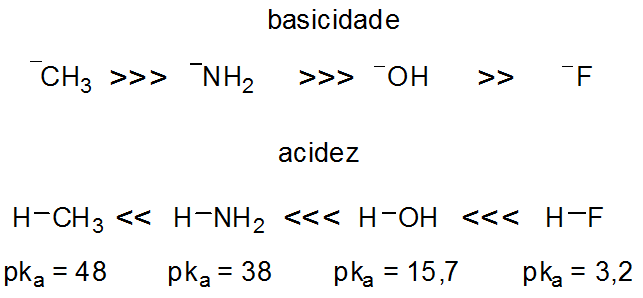
O efeito da eletronegatividade fica evidente ao observar a acidez no segundo período. As bases conjugadas mais fracas são mais estáveis e, portanto, mantém o equilíbrio para sua formação:
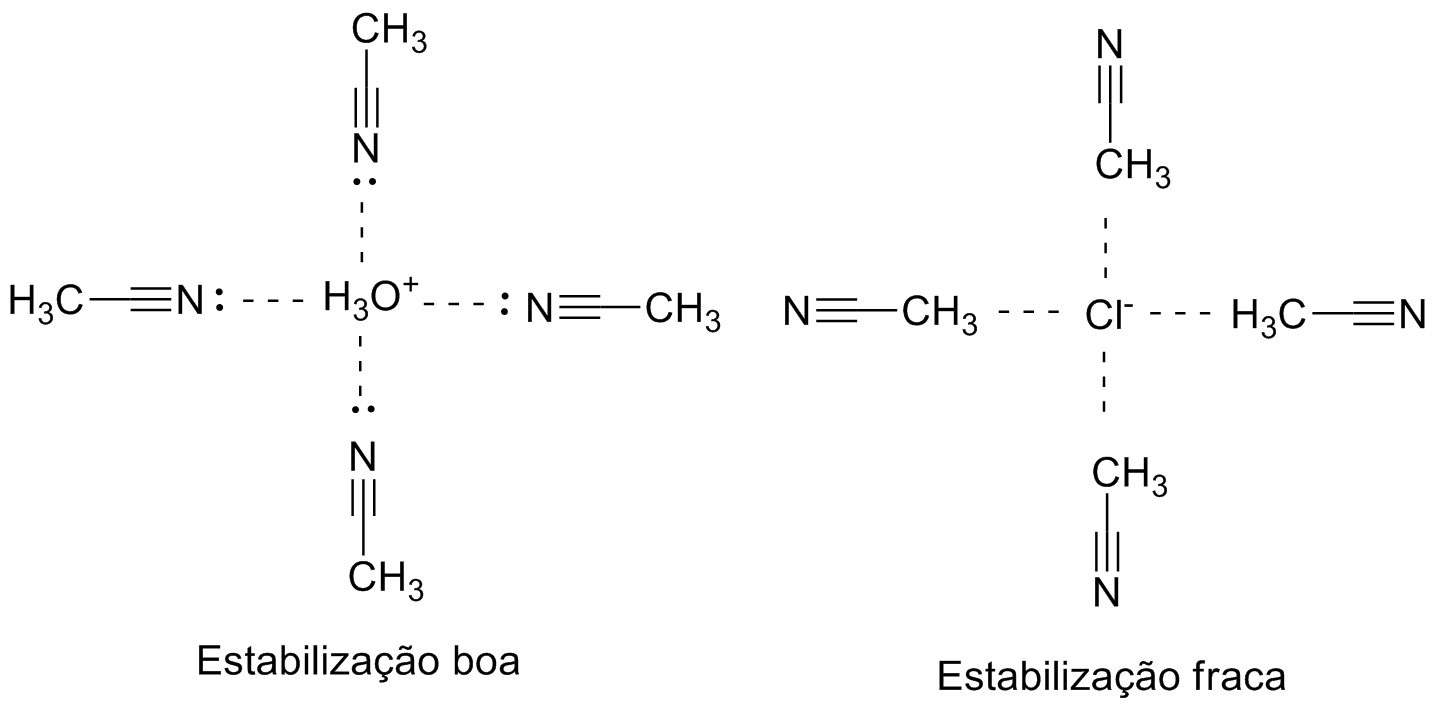
Efeito do Solvente
Em fase gasosa os ácidos possuem valores de pKa muito diferentes dos obtidos em água: o ácido acético possui pKa ~130. Isso ocorre porque em fase gasosa quase não há choque entre as moléculas, obrigando a separação de cargas sem estabilização e a formação do hidrônio como ácido conjugado que é extremamente ácido.
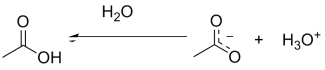
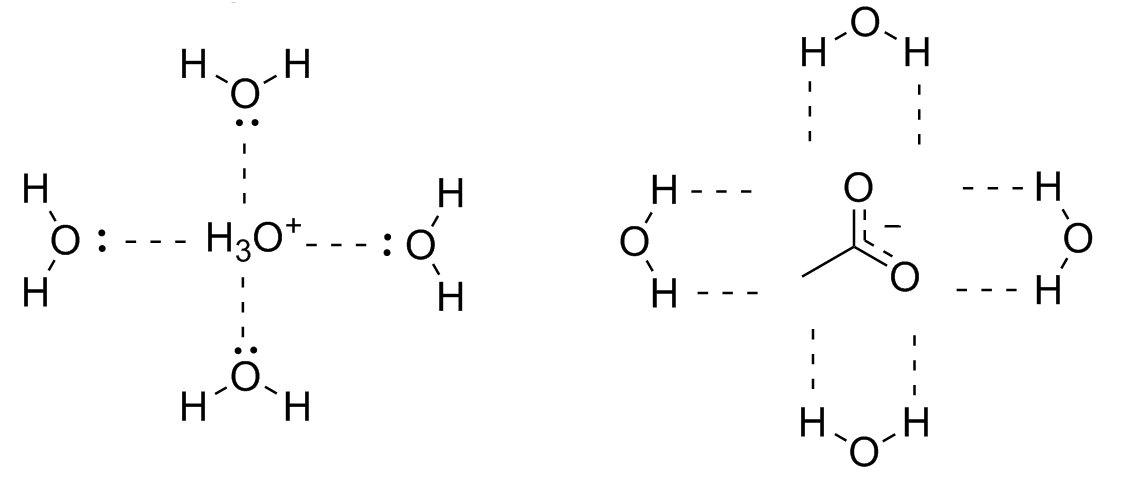
Em solução, esse hidrônio pode ser circundado por sucessivas camadas de água que ajudando a estabilizar a carga formada pela aproximação dos pares de elétrons do oxigênio com a carga positiva. O acetato é circundado pelos hidrogênios da água que se aproximando da carga negativa. Esse fenômeno é chamado de solvatação.
Solventes polares próticos estabilizam melhor as cargas do que os apróticos, aumentando a acidez relativa. Por esse motivo, os pKa obtidos em acetona e DMSO devem ser corrigidos para permitir a comparação com os obtidos diretamente em água.
Nem todos os solventes estabilizam igualmente as cargas formadas. Dependendo da natureza dos solventes as cargas positivas são melhor estabilizadas do que as negativas, ou vice-versa. Como a solvatação atrapalha os choques entre as espécies carregadas, essa característica pode ser explorada em estratégias de síntese para maximizar os choques entre espécies de interesse.