Funções de Onda
A interpretação ondulatória do elétron permitiu identificar que a distribuição eletrônica por orbitais tridimensionais ao invés de órbitas bidimensionais é uma descrição melhor suportada pelas evidências. Através da mecânica quântica foi possível obter as equações matemáticas (funções de onda) que definem esse orbitais:

Cada orbital atômico é único e identificado por seus respectivos números quânticos. Devido às limitações impostas pelo problema de múltiplos corpos, as funções de onda acima só possuem solução analítica (resolução completa) para o átomo de hidrogênio e átomos hidrogenóides (com apenas um elétron).
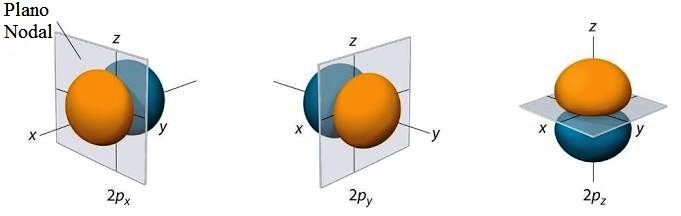
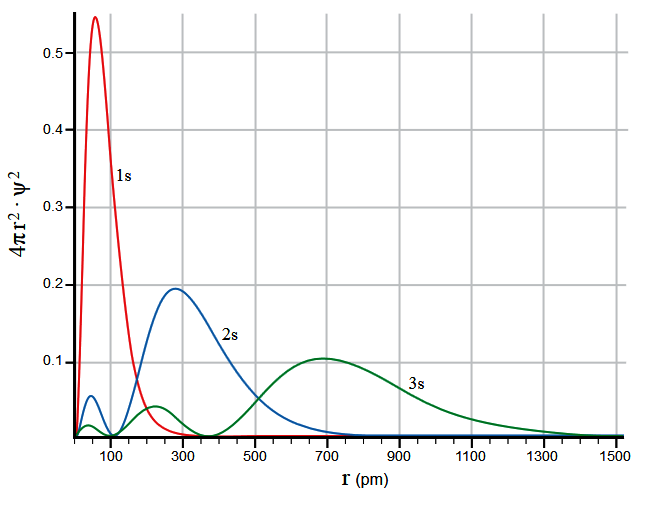
À exceção do menor orbital s, todos os orbitais tem ao menos um nó, ou seja, uma região do espaço em que não é possível encontrar o elétron - em todos os demais pontos no espaço a probabilidade é não nula. Os nós podem ser identificados no gráfico bidimensional abaixo como os pontos onde a curva toca a abscissa r (raio atômico).
A capacidade eletrônica de cada orbital, com os spins emparelhados, é dada por
Orbital |
Máx. de elétrons |
| s | 2 |
| p | 6 |
| d | 10 |
| f | 14 |
Orbitais Tridimensionais
A densidade de probabilidade é a medida da probabilidade do elétron se encontrar em determinado intervalo de espaço. A aplicação desse conceito às funções de onda do elétron permite descrever tridimensionalmente os orbitais atômicos:
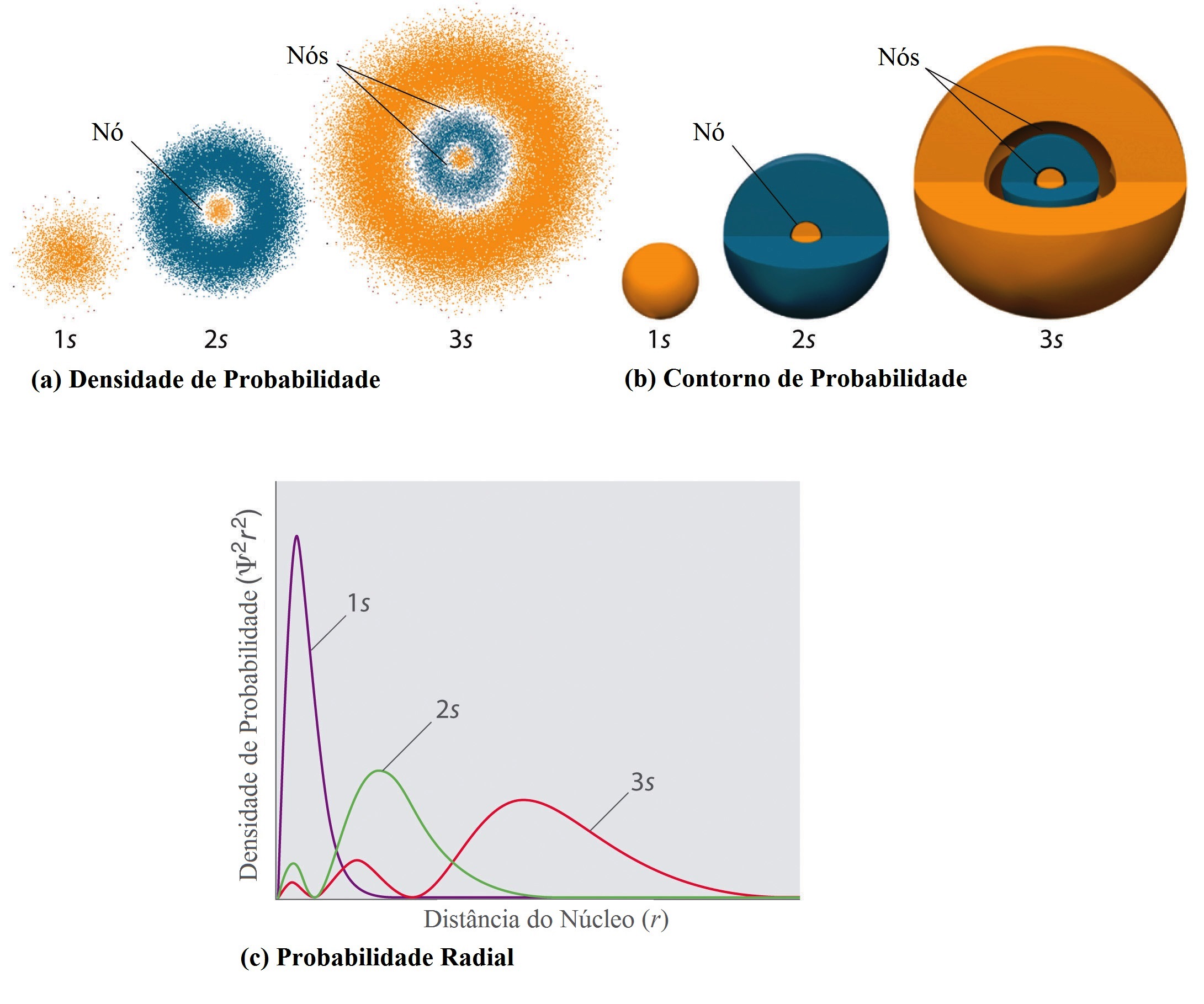
A aplicação desse princípio às demais funções de onda leva à descrição dos orbitais atômicos para o hidrogênio - e aos outros elementos por aproximação. Tridimensionalmente os nós se tornam planos nodais como indicado para os orbitais p.