O creme dental é um dos produtos de higiene pessoal mais essencial. Como a Química permite que tenhamos dentes saudáveis através de seu uso?
Por Carlos Vinícius Pinto dos Santos

Figura 1 - O creme dental é um dos itens fundamentais de higiene pessoal
O creme dental é usado desde o Egito Antigo (século IV a.C.), mas apenas a partir da metade século XIX seu uso se popularizou. Dentre os componentes mais utilizados figuravam o sal, pimenta, carvão e ervas aromáticas. As primeiras escovas eram usadas desde 1498 na China, apesar de indícios apontarem escova mais antigas na Europa.
O creme dental moderno teve sua concepção definida a partir da década de 40 com a introdução de compostos fluorados, incorporando resultados de pesquisas relacionando seu uso com a prevenção de cáries1,2,3. O mecanismo de limpeza bucal é baseado no efeito mecânico da escova de dente e componentes do dentifrício e da ação do fluoreto na camada externa do esmalte dentário.
Composição
A composição dos cremes dentais é de 20-55% de abrasivos, 15-25% de água, 0,2-0,3% de fluoreto, 20-35% de umectantes, 1-3% de tensoativos, 1-3% de espessantes e 1-2% de flavorizantes4. Outros componentes como conservantes, corantes e efeitos estéticos variados são adicionados em quantidades inferiores a 1%. Os clareadores químicos, agentes para redução de sensibilidade e redução de tártaro podem ser adicionados em cremes dentais específicos.
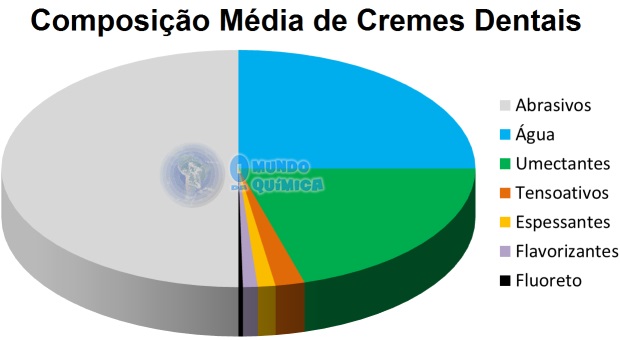
Figura 2 - Composição média de cremes dentais
Abrasivos
Habitualmente, estão em maior quantidade nos cremes dentais. São substâncias responsáveis pela remoção mecânica das partículas indesejadas da superfície dental em conjunto com as cerdas da escova de dente. Enquanto as cerdas removem as partículas maiores, os abrasivos atuam na remoção de partículas pequenas que estão aderidas à superfície. Uma analogia válida são as funções da esponja e da palha de aço ao limpar uma panela: a esponja remove a sujeira em maior quantidade e menos aderida ao metal, enquanto que a palha de aço remove os resíduos mais aderidos ao polir o metal da panela. Naturalmente, só serão removidas as partículas acessíveis às cerdas. Também é possível adicionar abrasivos mais duros que o esmalte para polir a superfície e gerar um efeito de clareamento por erosão. É um método que, se usado sem o devido cuidado, pode causar hipersensibilidade e problemas mais sérios ao dente. Consulte sempre um profissional.
A granulometria dos abrasivos varia em função dos efeitos desejados. Grãos maiores proporcionam limpeza, enquanto que grãos finamente divididos geram o efeito de polimento5. As partículas podem ter tamanhos de 4-12 µm6,7.
Geralmente, os abrasivos são substâncias insolúveis, sendo as mais comuns o óxido de silício (SiO2), óxido de alumínio (Al2O3), carbonato de cálcio (CaCO3), zeólitas, mica, terra diatomácea, vários tipos de fosfatos de cálcio - dentre eles o mineral componente dos dentes, a hidroxiapatita (Ca10(PO4)3(OH)2)5,6,7. O bicarbonato de sódio (NaHCO3) também é utilizado como abrasivo, apesar de não ser insolúvel (7,8g/100g)11.
Cabe salientar que os fosfatos de cálcio podem ser adicionados também como remineralizadores.
Fluoretos
Desde a década de 40 o flúor é adicionado à composição do creme dental por diminuir a incidência de cáries1,2,3,8. O flúor é fornecido como fluoreto, tendo como fontes mais comuns o fluoreto de sódio (NaF) e o monofluorfosfato de sódio (Na2PO3F). O fluoreto de estanho II (SnF2) também pode ser usado, como a ação extra de controlar a gengivite6.
Os cremes dentais tem usualmente 1000-1500ppm (ou 1000-1500mg/L) de flúor4,7,8. Apesar de pequenas quantidades de creme dental não surtir sérios danos, sua ingestão não é recomendada em nenhuma quantidade.
Umectantes
Tem a função de manter a umidade correta para o uso do creme dental. Podem ser utilizados a glicerina, sorbitol (sacarídeo) e o etilenoglicol. O etilenoglicol tem seu uso minimizado por ser potencialmente tóxico.
Surfactantes/ Tensoativos
São substâncias responsáveis pela estabilização dos diversos ingredientes, mantendo-os homogêneos, além de produzir espuma no ato da escovação. O mais comum é o laurilsulfato de sódio4,7, presente em diversos outros produtos de higiene pessoal como xampus e sabonetes líquidos.
Clareadores
Além do polimento mecânico, é possível clarear quimicamente o dente. Para tanto, são utilizadas substâncias oxidantes como peróxido de hidrogênio ou o peróxido de carbamida (mistura de ureia com peróxido de hidrogênio). Os pigmentos orgânicos que escurecem o dente são decompostos em água, gás carbônico e substâncias menores que podem então ser removidas pela escovação. Nos cremes dentais com função clareadora a concentração média é de 1,5% m/m.
Flavorizantes
Apesar de os sabores de menta e hortelã serem os mais difundidos, vários outros podem ser encontrados como canela (cinamaldeído), laranja, limão, baunilha, tutti frutti, pêssego, etc. Apesar de menos comuns, cremes dentais sem sabor também são comercializados.
Agentes para diminuir hipersensibilidade
Atuam bloqueando receptores na superfície do dente. Sais de potássio, como o cloreto de potássio (KCl) e nitrato de potássio (KNO3) são os mais comuns e tem se mostrado eficientes. Também pode ser utilizado cloreto de estrôncio (SrCl2)9.
Espessantes
São substâncias utilizadas para incrementar a viscosidade do creme dental estabilizando-o estruturalmente. Podem ser utilizados poliglicóis, goma xantana e o mais comum metilcelulosecarbóxido de sódio.
Escoamento
O creme dental tem o escoamento de um fluido não-newtoniano, que é um fluido que tem sua viscosidade alterada em função da tensão aplicada. Esse comportamento permite que, em repouso, o creme dental se comporte como um sólido e quando o tubo é pressionado, a tensão aplicada o faz se comportar como um líquido. O escoamento só ocorre quando a tensão ultrapassa um valor crítico, denominado tensão limite de escoamento, de modo que se for aplicada uma tensão pequena o suficiente no tubo não será notada a expulsão do creme dental. Outros materiais que tem comportamento semelhante são a argila e as graxas10,11.
A composição do creme dental, rico em sólidos e permeado por uma solução aquosa de alta viscosidade, ajuda a explicar o comportamento observado. O empilhamento das partículas sólidas preenchidas pelo líquido torna a arrumação estável em repouso pela elevada viscosidade do conjunto. Quando uma tensão é aplicada, ao mesmo tempo em que ocorre graças ao líquido, sua alta viscosidade mantém a organização estrutural praticamente inalterada durante e após a aplicação da tensão.
Hidroxiapatita x Fluorapatita
A hidroxiapatita (Ca10(PO4)3(OH)2) é o principal componente estrutural dos ossos e dentes. Apesar de ter baixíssima solubilidade (Kps = 3,6x10-59 a 25ºC)12, a hidroxiapatita pode reagir com ácidos a partir de pH = 5,5. Bactérias presentes na boca degradam açúcares em ácidos, como o láctico, que atacam o esmalte e o dissolvem lentamente13. Alimentos podem surtir o mesmo efeito, uma vez que alimentos ácidos consumidos com frequência podem enfraquecer o esmalte. A título de nota, os refrigerantes tem valores de pH 1,78 a 2,6214.
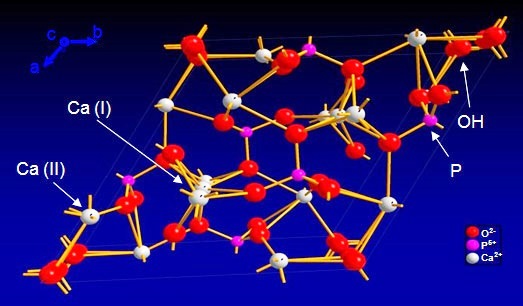
Figura 3 - Estrutura química da hidroxiapatita a partir de difração de raios-X
A fluorapatita é um mineral com estrutura (Ca10(PO4)3F2), mas possui a vantagem de ser mais resistente a ataques ácidos15. Para converter a hidroxiapatita é necessário substituir as hidroxilas (OH-) pelos fluoretos (F-). Como nas condições fisiológicas a reação é lenta, tanto pelas condições brandas quanto pela necessária baixa exposição, se faz necessário o uso prolongado para obtenção dos efeitos desejados. Num consultório, por exemplo, a aplicação de gel ácido com flúor a 2% e laser acelera a reação e produz bons resultados na formação da fluorapatita e consequente resistência a ácidos15.
Figura 4 - Aplicação profissional de "flúor" para formação de fluorapatita
Polêmicas sobre o flúor
Desde o início de seu uso, o flúor tem recebido críticas por ser potencialmente danoso. Muita confusão é feita sobre sua administração e é importante frisar que a forma do flúor disponibilizada é a aniônica, ou seja, o fluoreto. O flúor como molécula diatômica (F2) é muito tóxico, pois reage com qualquer coisa para formar dois fluoretos, que são estáveis. Esse tipo de flúor não é usado em nenhum produto e os órgãos públicos de controle se certificam de que não esteja em contato com o público.
O fluoreto em si tem toxicidade, muito por sua elevada afinidade para reagir com o cálcio e formar fluoreto de cálcio (CaF2). Possui baixíssima solubilidade: com Kps = 3,45×10-11 sua solubilidade é de 3,5x10-3g/L, ou seja, para dissolver 1g são necessários 285L de água. Assim, o fluoreto irá reagir de maneira indiscriminada e irreversível com qualquer cálcio que tenha contato, seja cálcio livre da alimentação, cálcio de proteínas ou, em última instância, cálcio dos ossos.
Tendo como base o fluoreto de sódio, NaF, a dose letal corresponde à ingestão de 5-10g16, ou 32-64mg/Kg de fluoreto. Utilizando um creme dental de 90g com 1500ppm de flúor (1500mg/Kg), é necessária a ingestão de 300 a 600 tubos de creme dental. A toxicidade crônica é, portanto, o maior risco associado.
As doses crônicas em que há aparecimento de sintomas relevantes são de 0,2-0,3 mg/Kg de fluoreto16, o que seria correspondente para uma pessoa de 70Kg à ingestão de 14-21mg/Kg, ou 8 a 13 tubos diariamente. Entende-se por efeitos relevantes problemas gastrointestinais derivados da formação de HF, desnaturação proteica pelo sequestro de cálcio por fluoreto sérico e efeitos sérios à absorção de cálcio e início de deposição óssea. A ingestão de 90g de creme dental pode causar náuseas e vômito.
De modo geral, fluoretos, como qualquer outra substância solúvel em água, não são bioacumuláveis. A principal forma de o corpo tem de eliminá-lo é por via salivar e urinária17.
Uma vez que o creme dental não deve ser ingerido e ainda não há evidências científicas concretas que desestimulem seu uso, os produtos à base de fluoretos para higiene bucal são absolutamente seguros.
Referências
1 DEAN, H. T.; Endemic fluorosis and its relation to dental caries, Public Health Reports, Vol. 53, pag. 1.443-1.452
2 COX, G. J.; New knowledge of fluorine in relation to dental caries, Journal of the American Water Works Association Vol. 31, Nº 1, pag. 926.
3 MILLS, C. A.; Fluoride in Drinking Water and Dental Caries, The Journal of the Am. Med. Assoc., Vol. 114, Nº 2, pag. 179
4 Dental Heath Foundation - What is Toothpaste
5 WANG, B.; Cleaning, abrasion, and polishing effect of novel perlite toothpaste abrasive, The Journal of Clinical Dentistry., Vol. 24, Nº 3, pag. 88-93
6 Spectrum Chemical - Toothpaste Abrasives
7 PLANINSIC, G.; Explore your toothpaste, Physics Education, Vol. 41, Nº 4, pag. 311-316
8 CHAVES, M. M.; Odontologia social, 2º edição, Labor, Rio de Janeiro, 1977
9 MINKOFF, S.; AXELROD, S.; Efficacy of strontium chloride in dental hypersensitivity, J. Periodontol., Vol. 58, Nº 7, pag.470-474
10 Wikilivros - Mecânica dos fluidos/Viscosidade
12 MCDOWELL, H.; GREGORY, T. M.; BROWN, W. E.; Solubility of Ca5(PO4)3OH in the System Ca(OH)2 - H3PO4 - H2O at 5, 15, 25, and 37°C, Journal of Research of the National Bureau of Standards - A. Physics and Chemistry, Vol. 81A, Nº 2 e 3, , pag. 273-281
13 STEPHAN, R. M.; Changes in hydrogenion concentration on tooth surfaces and in caries lesions, Journal of The American Dental Association, Vol. 27, pag. 718-723
15 MATHEW, A.; REDDY, N. V.; SUGUMARAN, D. K.; PETER, J.; SHAMEER, M.; DAURAVU, L. M.; Acquired acid resistance of human enamel treated with laser (Er:YAG laser and Co2 laser) and acidulated phosphate fluoride treatment: An in vitro atomic emission spectrometry analysis, Contemp. Clin. Dent., Vol. 4, Nº 2, pag.170–175
16 DEAN, H. T.; Fluorine Intoxication, American Journal of Public Health and the Nations Health, Vol. 28, Nº 8, pag. 1008–1009
17 FILAPPI, A. R.; PRESTES, D. S.; ANTES, F. G.; FLORES, E. L. M.; DRESSLER, V. L.; FLORES, E. M. M.; CECIM, M.; Metabolismo e distribuição do flúor em ovinos jovens tratados cronicamente com fluoreto de sódio, Pesq. Vet. Bras., Vol. 28, Nº 2, pág. 124-128




