As bolhas de sabão encantam crianças e adultos. Como ocorre sua formação a nível molecular?
Por Carlos Vinícius Pinto dos Santos

Figura 1 - A produção de bolhas de sabão é uma das brincadeiras mais fáceis e baratas de ser executada
As bolhas de sabão se formam graças à diminuição da tensão superficial, que ocorre numa solução aquosa de um tensoativo. O tensoativo forma uma bicamada onde a face hidrofílica fica voltada para o interior, retendo a água, enquanto que a face hidrofóbica fica voltada para o exterior, em contato com o ar dentro e fora da bolha.
Para saber mais sobre tensão superficial visite Sabão.
Quando uma bolha é formada, apenas a parte hidrofílica mantém u estado de baixa energia, já que está interagindo com a água. A parte hidrofóbica assume um caráter de energia elevado, pois não interage bem com o ar e não há outra interação disponível. Assim, um arranjo geométrico que diminua a área superficial é espontâneo e menos energético, sendo esse o motivo de as bolhas tenderem a assumir o formato esférico rapidamente.
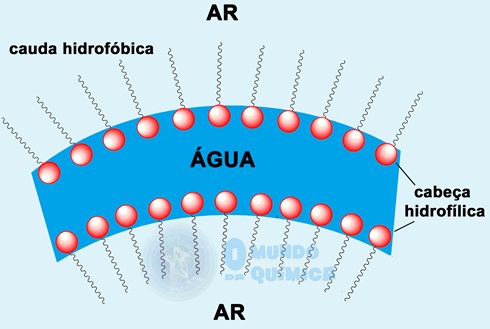
Figura 2 - Esquema simplificado da película da bolha de sabão
Existem vários tipos de tensoativos, divididos em iônicos ou não iônicos. Dentre os iônicos está o sabão (sais de sódio ou potássio de ácidos graxos) e os detergentes (sulfonatados ou fosfatados de ácidos graxos, compostos com ácidos sulfônicos aromáticos, dentre outros), enquanto que os não iônicos se aproveitam das interações de hidrogênio para gerar o comportamento surfactante, como o monoglicerídeo de ácido graxo (triglicerídeo parcialmente hidrolisado).

Figura 3 - As bolhas de sabão apresentam o fenômeno de iridescência
Um comportamento muito interessante numa bolha de sabão é seu brilho multicolorido. Tal fenômeno é conhecido como iridescência, também chamado de furta-cor, e chama a atenção por refletir as cores do arco-íris. Esse fenômeno ocorre por padrões de interferências construtivas (colorido) e destrutivas (negro, se identificável) quando a luz interage com a bicamada de tensoativo, com polarização da luz refletida. Esse fenômeno é bem estudado pela Física de Filmes Finos.
A estabilidade da bolha pode ser aumentada pela adição de espessantes como a glicerina, que também aumentam o brilho iridescente pelo seu maior índice de refração. A adição de açúcar tem efeito semelhante. Quanto mais elaborado e puro o tensoativo usado, melhor será o resultado. Assim, um detergente como o dodecilsulfato de sódio otimiza a estabilidade da bolha, permitindo bolhas maiores e de maior duração.
Alguns agentes atrapalham a estabilidade da bolha, como a água usada e condições atmosféricas. Água dura, através dos íons cálcio e magnésio, interagem fortemente com carboxilatos, sulfonatos e fosforatos, impedindo-os de participar da bicamada por precipitação. O uso de água destilada ou desmineralizada evita esse problema. A presença de poeira pode sensibilizar a bicamada, oferecendo um ponto de interação à parte hidrofóbica e causando o rompimento da bicamada. Ar muito seco também rompe a bicamada, de modo que dias úmidos são os melhores para fazer bolhas de sabão.
Agora que você já sabe como é a Química das bolhas de sabão, continue se encantando com o conhecimento da Química!
