Identificação de Halogênios - Método da Mineralização
A reatividade dos halogêneos varia radicalmente do flúor ao iodo. Alguns compostos iodados decompõe-se quase que espontaneamente para formar I2 enquanto muitos compostos fluorados chegam perto de serem inertes; iodetos, brometos e cloretos terciários, assim como clorados benzílicos e alílicos, reagem prontamente com AgNO3 para formar o respectivo halogeneto de prata; iodetos de modo geral reagem facilmente, mas nem sempre são de fácil detecção, brometos e cloretos podem ser mineralizados mais facilmente e identificados e os fluoradas são difíceis de mineralizar mas nem tanto para identificar.
Diante desse cenário um método para isolar e detectar halogênios é a mineralização, como nos ensaios de Lassaigne e pirólise com CaO.
O ensaio de Lassaigne (1843) utiliza o sódio metálico na pirólise para mineralizar a amostra orgânica e identificar os heteroátomos. É um método universal já que se aplica a enxofre (formando sulfeto ou tiocinato se nitrogênio estiver também presente), nitrogênio (formando cianeto) e os halogênios (formando os halogenetos), além de também identificar fósforo (formando fosfato). Uma única pirólise é suficiente para produzir o licor que será utilizado nos ensaios de identificação dos heteroátomos.
Entretanto, devido aos cuidados no trato com o sódio metálico, que no ensaio deve ser fundido (portanto mais reativo), a eventual falta deste no almoxarifado e a necessidade de trincar o microtubo em água seu uso é evitado. Por esse mesmo motivo sua descrição foi omitida anteriormente em preferência a métodos mais fáceis e seguros.
A pirólise com óxido de cálcio produz resultado semelhante com a vantagem de abolir o sódio metálico, entretanto a necessidade de trincar o microtubo por choque térmico e os tratamentos posteriores não podem ser eliminados.
Esses dois métodos, pirólise com CaO e o de Lassaigne, são os únicos que permitem abrir uma amostra de halogêneos. Contudo é possível dividir os ensaios em três de acordo com as reatividades dos halogêneos: Flúor (Método da mineralização), Cloro e Bromo (Método da Sulfocrômica) e Iodo (Pirólise com areia).
► Identificação de Flúor - Método da Mineralização
Interferentes - Não há
Ensaio de Lassaigne - Em um microtubo se adiciona uma gota ou cerca de 1 mg (equivalente ao volume de um grão de alpiste ou ao volume recolhido pela ponta de um palito de fósforo). Com o tubo inclinado colocar um pedaço do tamanho de um grão de arroz na parede à meia altura. Utilizando uma pinça de madeira aquecer o tubo até que o sódio funda e escorra até o fundo, onde deve-se aquecer a mistura ao rubro. Com óculos de segurança e em capela, imergir o tubo ainda ao rubro em um béquer de 50mL com pelo menos 10mL de água. O tubo se estilhaçará, o excesso de sódio será eliminado e os sais de sódio passarão à solução. Ferver o conteúdo do béquer por 3 minutos e filtrar. O filtrado deve ser límpido e claro, caso contrário a mineralização não suficiente e deve ser repetida com nova amostra. A solução deve ser utilizada na identificação do flúor.
Pirólise com CaO - Basta substituir o sódio metálico na parede do microtubo pelo CaO misturado à amostra na proporção 10:1. É possível que parte do flúor se perca no precipitado como CaF2. Para diminuir essa perda o produto da pirólise é trado com HCl concentrado antes da filtração. A solução obtida é então testada com uma gota do reagente alizarina-zircônio. A passagem de violeta para amarelo indicará a presença de flúor.
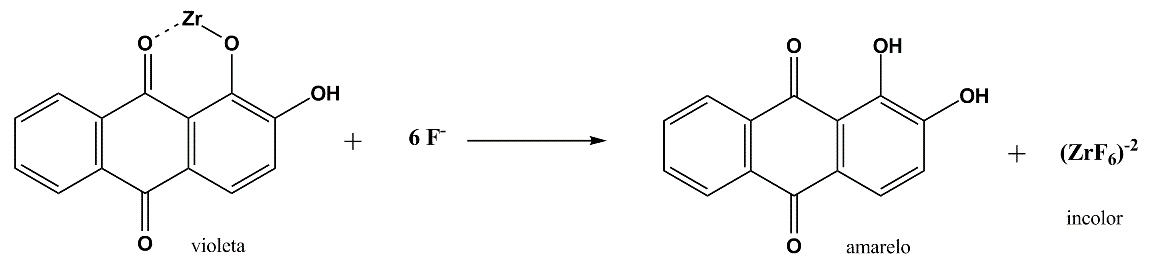
O complexo de alizarina com zircônio possui coloração violeta, enquanto a alizarina possui coloração amarela. Como o flúor é um complexante mais forte para o zircônio a troca libera a alizarina e a mudança de coloração percebida.
► Identificação de Iodo - Método da Pirólise
Interferentes - Não há
A pirólise com areia proporciona o craqueamento da estrutura e liberação de I2. A depender da quantidade de amostra e de iodo na molécula é possível observar os vapores arroxeados de I2 dentro do tubo. A presença de iodo deve ser confirmada pelo reagente goma de amido (amido 15-20% p/V em meio ácido), onde a presença de iodo gera uma aduto com a cadeia espiralada de glicose no amido de coloração azul intensa.

Referências
1 Adaptado de Apostila de Análise Orgânica, CEFET Química Nilópolis, 2005
2 Costa Neto, C.; Análise Orgânica, Métodos e Procedimentos para a Caracterização de Organoquímios, Vol. 1, 4º Edição, Rio de Janeiro: Editora UFRJ, 2004
3 Shriner, Fuson, Curtin e Morrill; Identificação Sistemática dos Compostos Orgânicos, 6º Edição, Rio de Janeiro: Editora Guanabara, 1983