Por Carlos Vinícius Pinto dos Santos
Os aminoácidos são os constituintes básicos das proteínas. Trata-se de um grupo de substâncias que contém em sua cadeia principal um ácido carboxílico e uma amina ligados a um carbono (chamado de carbono α), que completa sua valência com um hidrogênio e um grupo R como substituinte. Os aminoácidos podem reagir entre si formando ligações peptídicas, que nada mais são que amidas. Dessa forma, proteínas são basicamente poliamidas compostas por monômeros com diferentes substituintes.
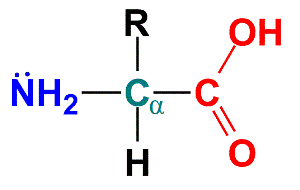
Figura 1 - Estrutura química genérica de um α-aminoácido
Os aminoácidos mais comuns são formados por 20 estruturas que diferem apenas no substituinte R.
Tabela 1 - Dados dos 20 α-aminoácidos mais comuns
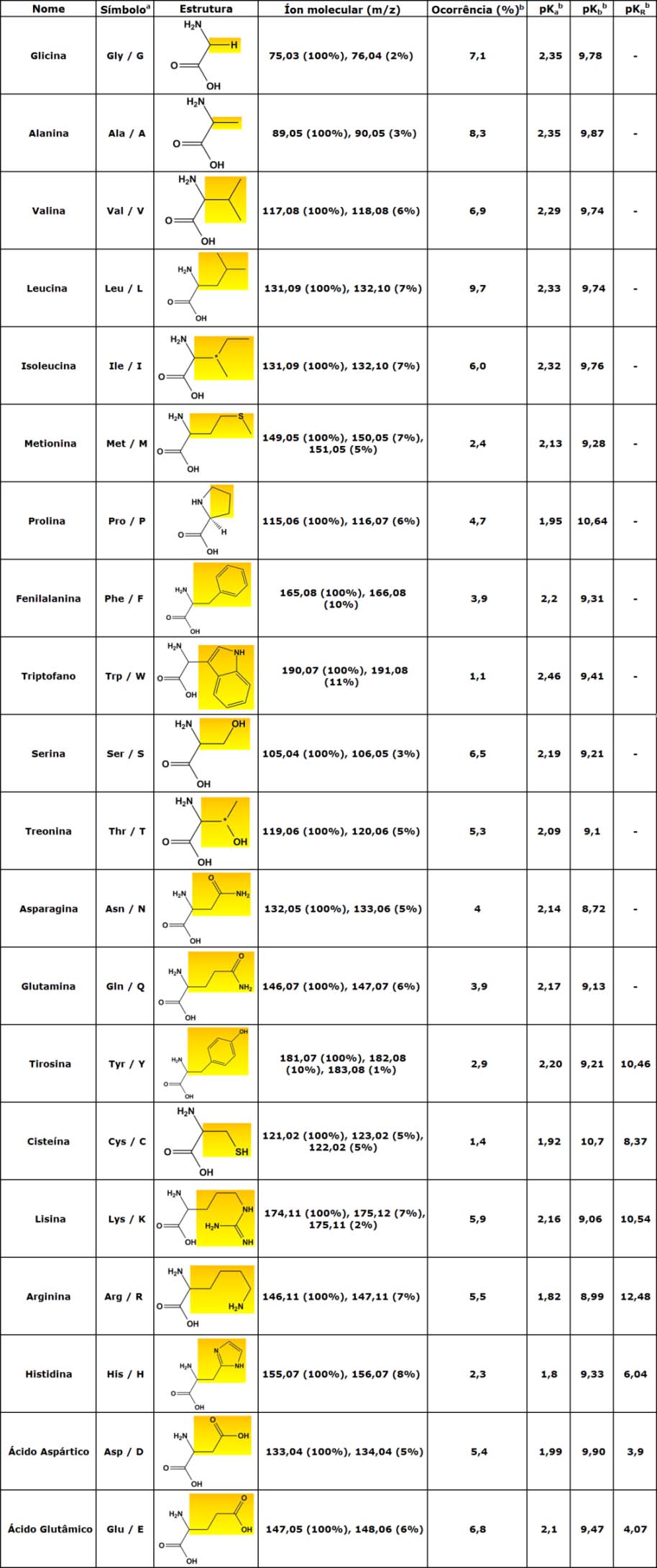
a Albert L. LEHNINGER, David L. Nelson, Michael M. Cox; Lehninger Principles of Biochemistry, 4th Edition, W. H .Freeman, 2004, pag. 74
b Donald VOET, Judith G. VOET; Biochemistry, 4th Edition, John Wiley & Sons, 2011, pag. 68 a 69
Além dos 20 aminoácidos mais comuns, existem outros aminoácidos1 que são modificações das estruturas comuns. A desmosina, por exemplo, possui importante atuação estrutural na fibra proteica colágeno, a mais abundante em mamíferos. As modificações comumente ocorrem no grupo amino através de metilação ou acetilação, mas também incluem hidroxilação e fosforilação em outras posições.
Outros derivados atuam de maneira mais específica, pois além de se tornarem incapazes de formar proteínas, possuem importantes funções reguladoras no organismo. Os principais são a histamina - vasodilatadora e constritora de músculos lisos, atua em respostas imunológicas2; dopamina - neurotransmissor atuante nos movimentos, aprendizado, cognição, memória, sono, humor, emoções3; tiroxina (T4) - hormônio tireoidal4; ácido γ-amino butírico (GABA) - regulação do tônus muscular, principal neurotransmissor em mamíferos5; homocisteína - indicação clínica para risco de doenças cardiovasculares6.
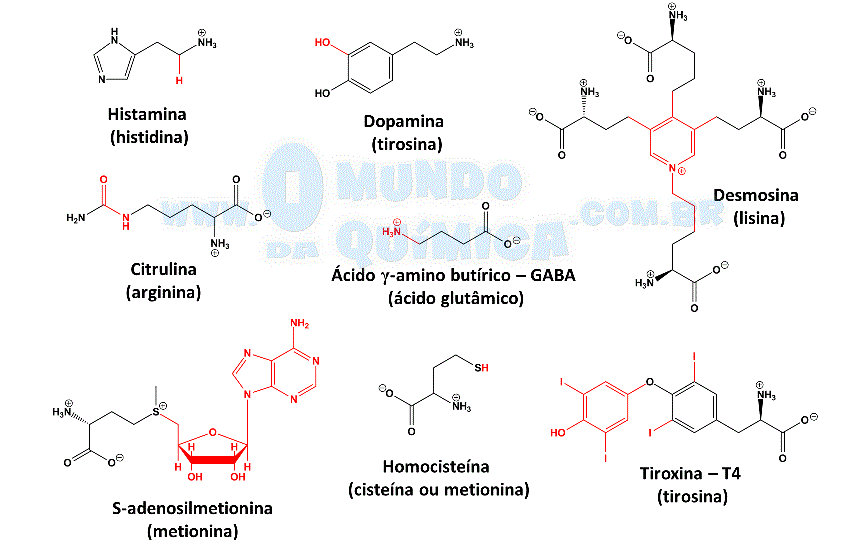
Figura 2 - Substâncias bioativas derivadas de α-aminoácidos
Os aminoácidos possuem caráter anfótero, ou seja, possuem grupos que podem reagir tanto como ácidos quanto como bases. Entretanto, a predominância de uma ou outra forma varia com o pH.
Das espécies iônicas há uma que se destaca: a forma onde tanto o amino protonado quanto o carboxilato estão presentes. Essa forma é chamada de zwitterion, do alemão que significa "íon hermafrodita", também chamado de sal interno.

Esquema 1 - Equilíbrio do zwitterion
Os aminoácidos são oticamente ativos, exceto pela glicina que não possui centro quiral. Na hidrólise ácida a água realiza o ataque nucleofílico aleatoriamente, de modo que nos aminoácidos obtidos desta forma há mistura racêmica. Em proteínas o estereoisomêro L é o dominante, o D é extremamente raro.
Aminoácidos Essenciais e Não-essenciais
Dos 20 aminoácidos básicos, o corpo humano (e a maioria dos mamíferos) tem biossíntese apenas para 11: glicina, alanina, prolina, serina, asparagina, glutamina, tirosina, cisteína, arginina, ácido aspártico e ácido glutâmico. Como é possível sintetizá-los a partir de estruturas mais simples são chamados de não-essenciais, ou seja, não é necessário adquiri-los da dieta.
Os 9 aminoácidos restantes - valina, leucina, isoleucina, metionina, fenilalanina, triptofano, treonina, lisina e histidina - não possuem rota metabólica em humanos e, para compor as proteínas e derivados, é necessário adquiri-los na dieta. Pela necessidade de seu consumo, são ditos aminoácidos essenciais.
Aminoácidos essenciais nos alimentos
Existem alimentos que contém quantidades relativamente elevadas de certos aminoácidos. Confira a listagem abaixo com alimentos que tem boas quantidades de aminoácidos essenciais7.
Valina - carnes, lácteos, soja, feijão, amendoim, castanha de caju, castanha do Pará, cacau, beterraba, berinjela, alho.
Leucina - carnes, lácteos, ovo, amendoim, castanha de caju, castanha do Pará, agrião, pepino, tomate, feijão, salsa.
Isoleucina - castanha de caju, castanha do Pará, amendoim, gergelim, ovos, abóbora, batata, lácteos, ervilha, feijão.
Metionina - ovos, castanha do Pará, lácteos, semente de abóbora, fígado de frango, soja, arroz.
Fenilalanina - aspartame, amendoim, lácteos, castanha de caju, castanha do Pará, alho, cebola roxa, banana, frango.
Triptofano - lactéos, amendoim, castanha de caju, carne de frango, ovos, ervilha, pescada, aveia, banana.
Treonina - ovos, lácteos, carnes, castanha de caju, castanha do Pará, abacate, cogumelos, feijão, berinjela, beterraba.
Lisina - leite desnatado, soja, peru (carne e coração), frango, ervilha, peixe, amendoim, ovo, feijão.
Histidina - ovo, lácteos, carnes, trigo integral, castanha de caju, castanha do Pará, cacau, ervilha, feijão, cenoura, aipim.
BCAA
Há uma série de estudos na literatura que apontam para a necessidade de consumir aminoácidos para incrementar a produção proteica e quais os melhores aminoácidos para a função. Os BCAA foram identificados como responsáveis diretos pela reestruturação muscular, ao lado de outros aminoácidos como a fenilalanina, descanso muscular e outros fatores2.
Se trata de um grupo de aminoácidos de cadeia ramificada (branch chain amino acid), composto por valina, leucina e isoleucina. É um termo relativamente controverso, uma vez que à exceção da glicina todos os aminoácidos possuem ramificações (em amarelo na tabela acima).
Os aminoácidos que compõe o BCAA foram identificados como os principais responsáveis pela recuperação proteica após catabólise, com a leucina como maior destaque3,4.
Referências
1 Donald VOET, Judith G. VOET; Biochemistry, 4th Edition, John Wiley & Sons, 2011, pag. 80




