Michael Faraday, famoso físico inglês, estudou a eletrólise1 para relacionar quantitativamente o aumento de massa de depósito em um eletrodo com a quantidade de eletricidade transferida. Dessa forma, Faraday descobriu as duas Leis da Eletrólise que levam seu nome. Em seu trabalho Faraday propôs a existência de íons, que seriam partículas responsáveis pela corrente elétrica em uma solução.
O químico francês François Marie Raoult também estudou soluções. Seus estudos culminaram, em 1887, na Lei que leva seu nome e diz que a pressão parcial de vapor de um solvente em equilíbrio com uma solução é diretamente proporcional à fração molar do solvente. Foi notado que o ponto de fusão de soluções é sempre menor que do solvente puro, e Raoult demonstrou que a diminuição do ponto de fusão é proporcional à quantidade de soluto.
O químico sueco Svante August Arrhenius fez uma série de ensaios de condutividade eletrolítica. Em 1884, baseado em seus resultados e no artigo "Theory of Aetherification" de Alexander William Williamson e Rudolf Clausius, Arrhenius propôs que as moléculas dissolvidas de um eletrólito são em parte "ativa" e em parte "inativa"2.
A solução aquosa de qualquer hidrato (por hidrato Arrhenius relacionou sempre compostos de hidrogênio como ácidos e bases) é composta, além da água, de duas partes: uma ativa, que são os eletrolíticos e outra inativa, que são não eletrolíticos. Estendeu a hipótese de outros eletrólitos dissolvidos (sais) e definiu o "coeficiente de atividade de um eletrólito"3.
Dessa forma, Arrhenius propôs em 1887 uma teoria ácido-base derivada de seus estudos eletroquímicos. De maneira simplificada, qualquer substância que em solução aquosa produza cátion(s) hidrogênio é um ácido e qualquer substância que produza hidroxila(s), nas mesmas condições, é uma base.
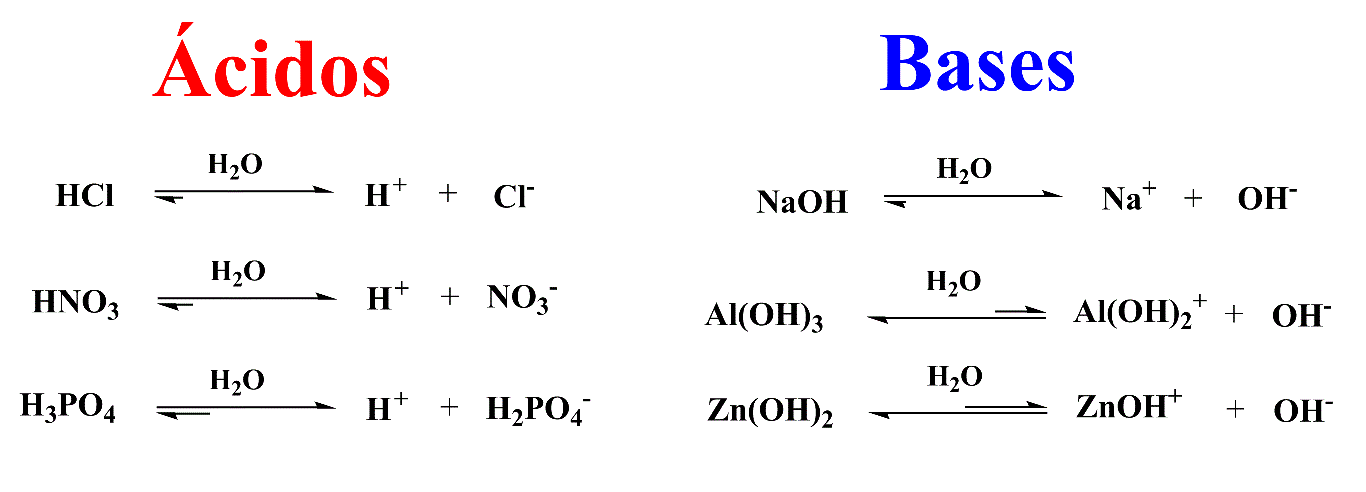
Caso um ácido e uma base se encontrassem, eles se neutralizariam produzindo água.
Apesar de simples e limitada a soluções aquosas relativamente diluídas, sua proposição deu origem a diversos estudos, dentre eles a Lei de Diluição de Ostwald (1887), a Equação de Nerst (1888), o efeito tampão (Fernbach, 1900) e o conceito de pH (Sørensen, 1909).
Hoje se sabe que a espécie H+ é de altíssima energia e é pouco provável que exista em solução isoladamente. Entretanto, a notação original será mantida.
Arrhenius observou que a água pode reagir entre si e gerar o íon hidrogênio e hidroxila. Em 1894 Friederich Kohlrausch e Adolf Heydweiller determinaram a constante de dissociação da água de 10ºC a 60ºC por conduntância, encontrando valores de 0,31.10-14 a 11,04.10-14. À 25ºC os valores encontrados eram próximos a 10-14. Já em 1904 Hans Friedenthal propôs que [H+]x[OH-] = 10-14.
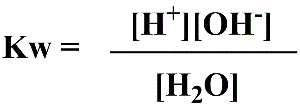
Como se tratam de valores muito pequenos para expressar a concentração de H+, utilizou-se o logaritmo negativo da [H+] introduzido por Sørensen em 1909. Dessa forma, os valores são melhor tratáveis e sempre positivos.
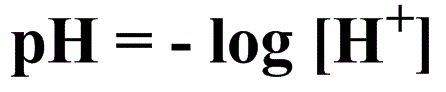
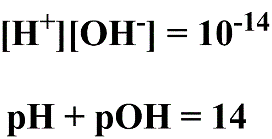
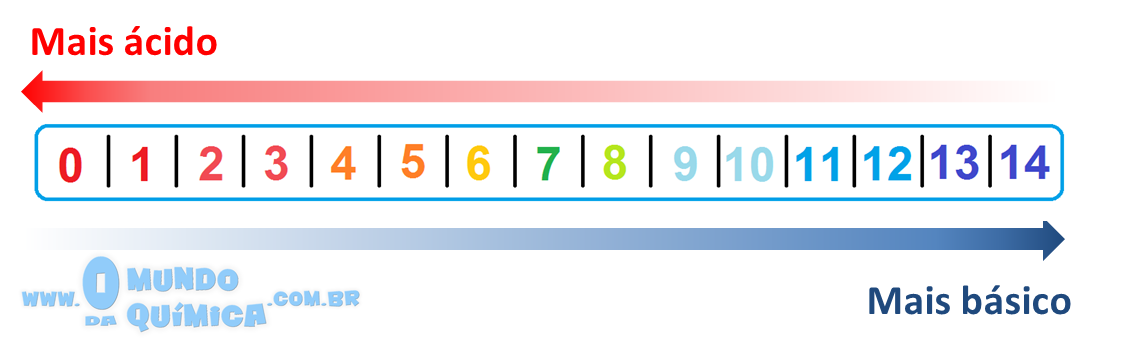
Assim nasce a escala de pH, de modo que o pH na água pode variar de 0 a 14 (nos extremos as medias costumam ser imprecisas) a 25ºC4 e concentrações de hidrônio dissociado até 1mol/L, já que valor maior retorna pH negativo.
Referências
2 Svante Arrhenius (1859-1927)
3 Encyclopedia - Svante August Arrhenius