Por Carlos Vinícius Pinto dos Santos
Os gases fazem parte de um dos estados da matéria, sendo caracterizados por partículas (átomos ou moléculas) que se movem livremente e ocupam todo o espaço disponível. Essa liberdade de movimento confere aos gases propriedades únicas, quase sempre muito diferentes dos sólidos e líquidos (fases condensadas), e que são descritas pelas Leis dos Gases.
Os gases se movem com grande velocidade (comparado às fases condensadas) e pouco interagem uns com os outros, o que torna sua densidade muito baixa. Mas, diferentemente dos sólidos e líquidos, os gases são compressíveis - seu volume (V) pode ser alterado. As principais grandezas associadas a mudança de volume nos gases são a temperatura (T), a pressão (p) e a quantidade de matéria (n).
Lei de Boyle-Mariotte
A pressão (p) de uma massa fixa de gás a temperatura (T) constante é inversamente proporcional ao seu volume (V). Em outras palavras, se aumentarmos a pressão sobre um gás, seu volume diminuirá, e vice-versa.
Essa Lei pode ser experimentada ao tampa uma seringa com um dedo e pressionar seu embolo simultaneamente. A pressão colocada no embolo diminuirá o volume do ar (confira na escala graduada, se houver) que, ao ter a pressão no embolo retirada, irá restaurar parte do volume inicial (perdas ocorrem numa seringa doméstica que não é totalmente estanque).
Outra forma de verificar essa Lei é com uma bexiga de ar que foi enchida ao nível do mar e foi levada a uma altitude maior. A diferença do valor da circunferência é perceptível mesmo a poucas centenas de metros de diferença.
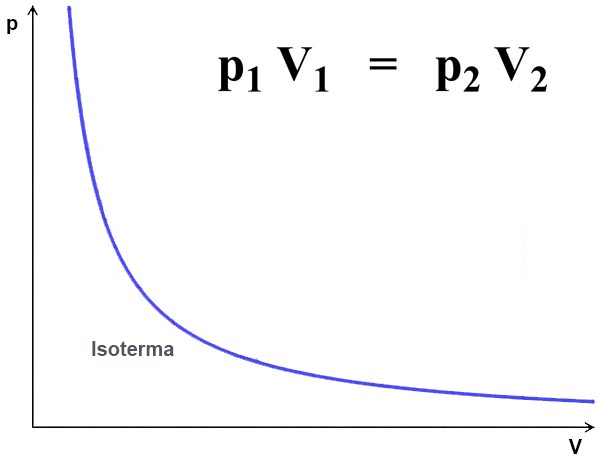
Figura 1 - Lei de Boyle-Mariotte
Lei de Charles
O volume (V) de uma massa fixa de gás a pressão (p) constante é diretamente proporcional à sua temperatura absoluta (T, em Kelvin). Ou seja, se aumentarmos a temperatura de um gás, seu volume aumentará, e vice-versa.
Essa Lei pode ser experimentada ao colocar uma bexiga cheia de ar no congelador. Após alguns minutos a baixa temperatura do ambiente iráreduzir seu volume, que pode ser restaurado ao retorná-la à temperatura ambiente.
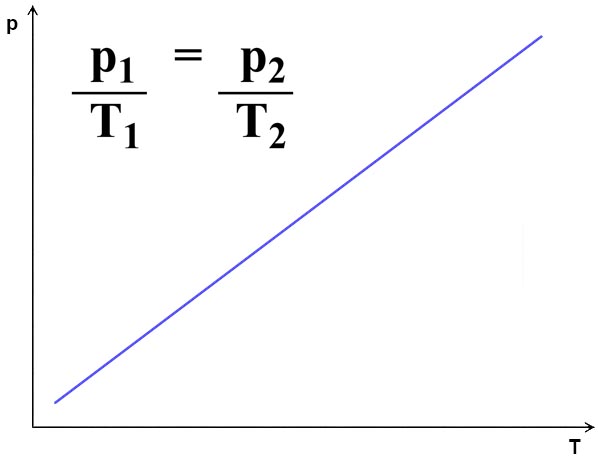
Figura 2 - Lei de Charles
Lei de Gay-Lussac
A pressão (p) de uma massa fixa de gás a volume (V) constante é diretamente proporcional à sua temperatura absoluta (T) . Isso significa que, se aumentarmos a temperatura de um gás em um recipiente fechado, sua pressão aumentará.
Essa Lei pode ser experimentada aoliberar o conteúdo de um gás sob pressão, como um extintor de CO2 ou um desodorante aerossol. A medida em que o gás é liberado a temperatura do recipiente diminui consideravelmente e chega a formar gelo caso um extintor seja pressionado tempo o suficiente.
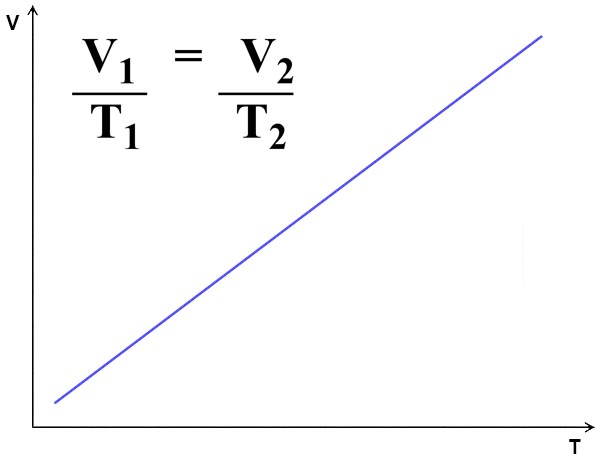
Figura 3 - Lei de Gay-Lussac
Quantidade de Matéria
Por fim, o aumento da quantidade de matéria (n) a pressão (p) e temperatura (T) constantes provoca o aumento do volume (V). Se o volume for mantido constante, a pressão e temperatura serão aumentados.
Isso pode ser observado ao encher um pneu muito vazio de um carro. Inicialmente, o ar injetado irá aumentar o volume do pneu com pouca variação na pressão. A medida em que as paredes do pneu e o peso do carro começam a restringir o aumento de volume a pressão aumenta e pode ser acompanhado pelo mostrador de pressão da bomba. A variação de temperatura é difícil de perceber em condições não controladas e a baixas pressões, mas são importantes quando as pressões são muito altas, como nas condições industriais.




