Por Carlos Vinícius Pinto dos Santos
O modelo atômico de Rutherford, proposto no início do século XX, representou um grande avanço na compreensão da estrutura da matéria. Através de experimentos com partículas alfa, Rutherford conseguiu desvendar uma nova visão do átomo, superando as limitações do modelo de Thomson.
O Experimento de Rutherford
Rutherford e seus colaboradores realizaram um experimento no qual bombardearam uma fina lâmina de ouro com partículas alfa (núcleos de hélio). A maioria das partículas atravessou a lâmina sem desvio, mas algumas foram desviadas em grandes ângulos, e algumas até mesmo retornaram.
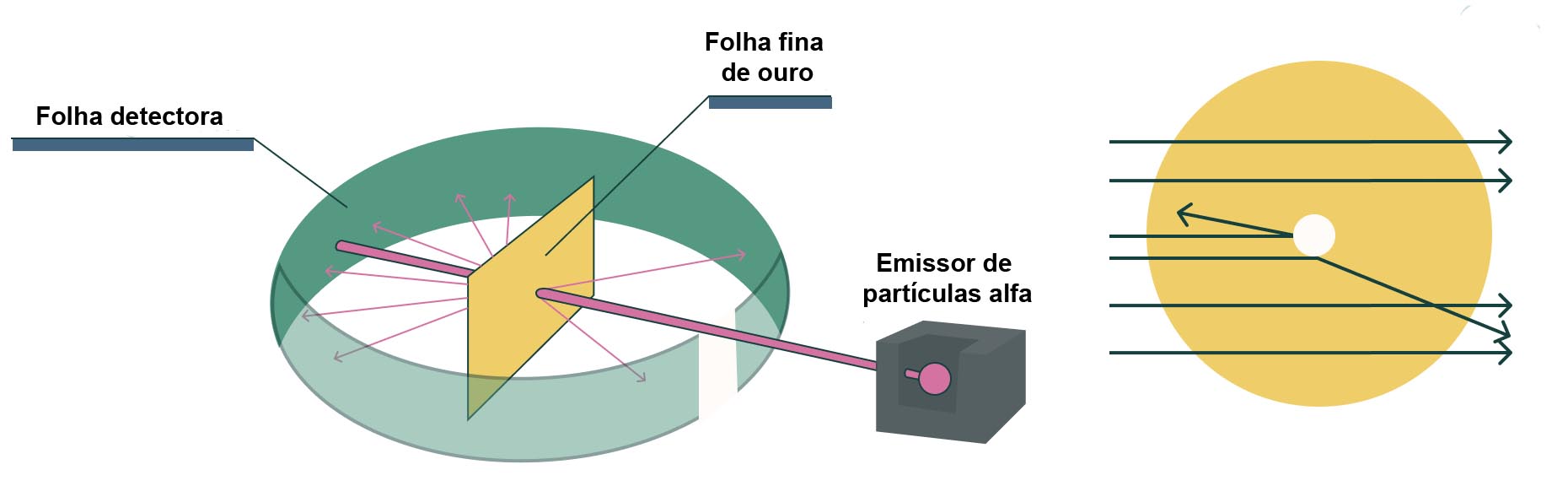
Figura 1 - Representação do experimento de Rutherford
A partir dos resultados do experimento, Rutherford chegou às seguintes conclusões:
• O átomo possui um núcleo central muito pequeno que concentra quase toda a massa do átomo e toda a sua carga positiva.
• Como o núcleo é muito pequeno em relação ao tamanho do átomo, a maioria do seu espaço interno é vazio.
• Os elétrons orbitam o núcleo: os elétrons, com carga negativa, orbitam o núcleo em órbitas circulares, semelhantes aos planetas orbitando o Sol.
Com base nessas conclusões, Rutherford propôs um modelo atômico que ficou conhecido como modelo planetário, por sua semelhança com o sistema solar:
Limitações do Modelo de Rutherford
Apesar de ser um grande avanço em relação aos modelos anteriores, o modelo de Rutherford também apresentava limitações importantes. Uma das mais críticas é que estava em desacordo com o eletromagnetismo clássico, já que era esperado que um elétron girando ao redor do núcleo carregado deveria perder energia até colapsar. Também era inútil para explicar as evidências da espectroscopia, dentre elas os espectros de linha e a radiação do corpo negro.
Entretanto, a descrição da divisão interna do átomo estava essencialmente correta, o que pavimentou o caminho para seu aluno, Niels Bohr, dar um salto quântico com o próximo modelo.




