Por Carlos Vinícius Pinto dos Santos
O modelo atômico de Bohr, proposto por Niels Bohr em 1913, representou um avanço significativo na compreensão da estrutura atômica, combinando os aspectos positivos do modelo de Rutherford com os primeiros conceitos da mecânica quântica.
Os Postulados de Bohr
• Órbitas estacionárias: os elétrons se movem em órbitas circulares específicas ao redor do núcleo, chamadas de órbitas estacionárias. Nessas órbitas, os elétrons não emitem nem absorvem energia.
• Quantização da energia: cada órbita está associada a um nível de energia específico e quantizado. Os elétrons só podem ocupar essas órbitas definidas.
• Transições eletrônicas: quando um elétron absorve energia, ele salta para uma órbita de maior energia. Ao retornar à órbita de menor energia, ele emite um fóton de luz com energia correspondente à diferença entre os níveis de energia.
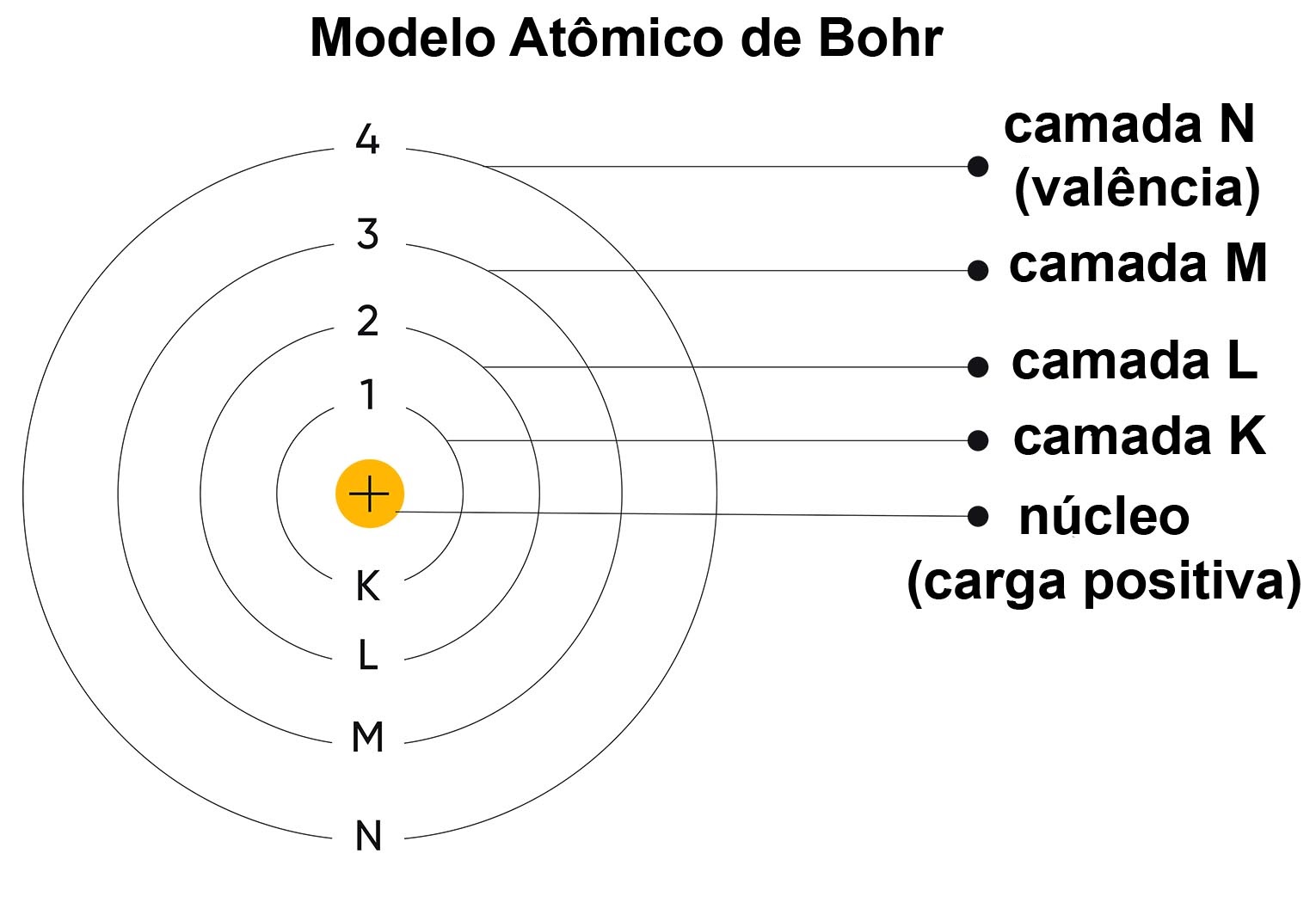
Figura 1 - Representação do modelo de Bohr
Uma das grandes contribuições do modelo de Bohr foi a explicação dos espectros atômicos. Os espectros atômicos são os padrões de cores emitidas por átomos excitados. Bohr propôs que cada linha espectral correspondia a uma transição eletrônica entre dois níveis de energia. Suas predições se mostraram corretas (com pequenas correções) mesmo com o avanço da tecnologia e emprego de teorias mais sofisticadas.
Limitações do Modelo de Bohr
Apesar de ser um grande avanço em relação a seus predecessores, o modelo de Bohr ainda apresenta algumas limitações:
• Embora explique as posições relativas das linhas espectrais com boa exatidão, não consegue explicar por que algumas linhas são mais intensas que outras.
• Não é capaz de explicar o efeito Zeeman, que é o desdobramento (duplicação) de linhas espectrais em um campo magnético.
• Propõe a capacidade de conhecer, ao mesmo tempo, a posição e energia do elétron em um átomo. Essa possibilidade foi refutada mais tarde por seu aluno, Werner Heisenberg, através de seu Princípio da Incerteza.
Apesar da persistência de limitações, o modelo atômico de Bohr responde a maioria das questões importantes em Química e fornece as bases para a compreensão das ligações químicas (através da ideia de camada de valência), interação entre matéria e luz (fotoquímica), divisão dos elementos na Tabela Periódica, dentre outros. É o modelo atômico mais robusto para uso no ensino médio.




