Por Carlos Vinícius Pinto dos Santos
A Lei Geral dos Gases Ideais combina as três leis anteriores - Lei de Boyle-Mariotte, Lei de Charles e Lei de Gay-Lussac - em uma única equação:
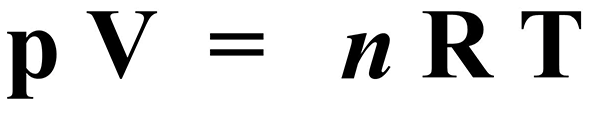
Figura 1 - Lei Geral dos Gases Ideais
onde:
p = pressão (Pa ou atm)
V = volume (m3 ou L)
n = número de moles (mol)
R = constante universal dos gases perfeitos (R = 8,31 J.mol-1K-1 ou R = 0,082 atm.L.mol-1K-1)
T = temperatura (K)
Essa equação é válida apenas para gases ideais, que são gases em que suas partículas colidem de forma perfeitamente elástica (interação nula entre as partículas). Na realidade, todos os gases reais desviam desse modelo sob altas pressões e baixas temperaturas, mas em condições relativamente brandas que respondem por muitos dos casos ela é válida.
Vantagem sobre as Leis Anteriores e Usos
Uma vez que as variáveis volume, pressão, temperatura e quantidade de matéria podem ser expressas ao mesmo tempo pela Lei Geral dos Gases Ideais, fenômenos interdependentes e complexos agora podem ser compreendidos através de seu uso. Máquinas térmicas e reações com presença de gases ou vapores (reagentes ou produtos) podem ser racionalizadas e ter comportamentos previstos, aumentando a eficiência e segurança de diversas reações industriais.




