Por Carlos Vinícius Pinto dos Santos
Cada substância química, seja ela qual for, tem um conjunto de propriedades químicas e físicas que a torna única. Quando uma reação química ocorre é comum que haja algum tipo de alteração no meio, uma vez que pelo menos parte da molécula inicial se tranformou em outras diferentes.
Essas alterações podem ser facilmente perceptíveis em alguns casos e, em outros, demandam técnicas muito sofisticadas para permitir a correta diferenciação. Dentre as características que podem ser utilizadas rotineiramente estão: variação de cores, de temperatura e mudanças de aspecto do meio.
Mudança de Cor
A cor de determinada substância se dá pela interação desta com a luz incidente. Cada molécula interage de maneira própria com a luz e, quando uma substância muda de cor, às vezes de forma abrupta, pode ser um indicativo de reação química. Em alguns casos essa variação de cor pode ser utilizada como um indicador visual de informações da reação.

Figura 1 - Erlenmeyeres com solução de fenolftaleína alcalina (esquerda) e ácida (direita)
Em alguns casos especiais a reação química produz luz em um fenômeno que é chamado de quimioluminescência. Uma dessas reações é a do luminol com ferro, utilizada no meio forense para detectar manchas de sangue ocultas.
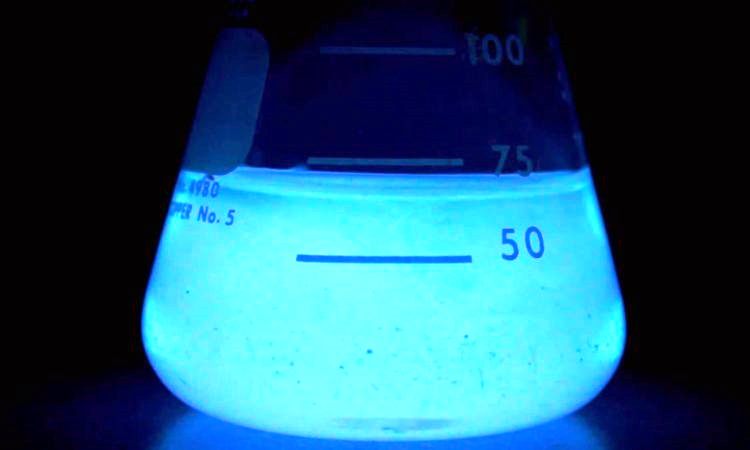
Figura 2 - Quimioluminescência do luminol
Mudanças de Temperatura
Na Natureza, o calor tende a se dissipar de forma expontânea, então tudo tende a se resfriar até que não seja mais possível. Isso siginifica que, para que algo aumente de temperatura, é necessário que seja fornecido calor por uma fonte (fogo, luz do Sol, etc.).
O contato de duas substâncias de mesma temperatura com formação de calor indica que foram formadas substâncias diferentes das iniciais com energias diferentes. Caso haja aumento de temperatura as substâncias formadas possuem energia menor que as anteriores e essa diferença é liberada e percebida como aumento de temperatura. Caso haja diminuição ocorre o contrário, as substâncias formadas tem energia maior que as anteriores e precisam absorver energia dos arredores, causando diminuição de temperatura.
Mudanças de Aspecto
A mudança de aspecto é uma das maneiras mais seguras de avaliar a ocorrência de uma reação química. Dentre elas pode-se citar a formação de sólidos e a formação de gases.
A formação de sólido, ou de precipitado, indica que uma substância que antes estava dispersa no meio se transformou em outra que não interage bem com o solvente, que pode ser a água.

Figura 3 - Precipitação de hidróxido de cobre (II)
Entretanto, é preciso cuidado. Não é sempre que a precipitação indica reação química. Se a água do mar for fervida em algum momento ocorrerá precipitação de sal, mas esse sal não sofreu alteração quimica em relação ao sal que estava antes na água, tanto que é possível utilizar esse mesmo sal com água limpa para reproduzir a água do mar.
A formação de gases (efervescência) é outra mudança de aspecto que indica com alguma segurança a ocorrência de reação química.

Figura 4 - Efervescência de um comprimido
Faíscas e fogo também indicam reação química. Durante a combustão de papel ou carvão, por exemplo, há a transformação desses materiais em gases e vapor de água, produção de luz e grande aumento de temperatura. Variações organolépticas como odor e sabor não são indicadas para serem usadas nessa análise uma vez que muitas substâncias químicas são danosas à saúde e não devem, nunca, ser ingeridas ou inaladas.




