Por Carlos Vinícius Pinto dos Santos
Em uma reação espontânea os produtos possuem menor energia que os reagentes e a reação flui no sentido da diminuição da energia potencial. Para que ocorra a quebra das ligações covalentes para a formação de novas é exigida grande quantidade de energia e essa barreira energética é chamada de energia de ativação (Ea ou ΔGǂ) - mesmo que a variação de energia seja favorável é necessário superar a Ea para que a reação ocorra.
Apenas algumas moléculas tem energia suficiente para superar a Ea e, quanto maior a Ea, menos moléculas poderão superá-la em dado instante. A taxa (ou velocidade) da reação está depende a magnitude da Ea. A velocidade de reação entre A e B é dada por
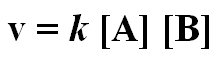
onde k é a constante de velocidade dessa reação. Dentro das mesmas condições, as constantes de velocidade podem ser comparadas para determinar qual reação é a mais rápida. A partir disso é possível relacionar k e Ea:
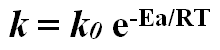
onde k0 é a constante de velocidade absoluta, k0 = 6,2 . 1012 s-1 a 25ºC. A Ea pode ser expressa diretamente pela Equação de Arrhenius:

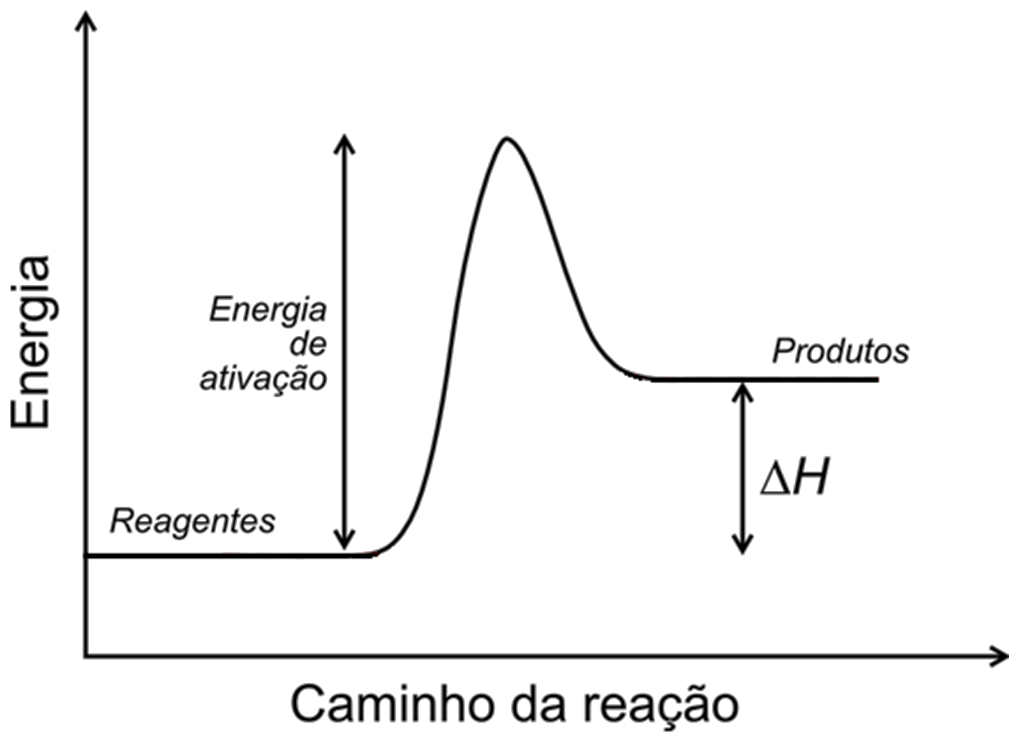
Figura 1 - Diagrama de energia para uma reação genérica




