Por Carlos Vinícius Pinto dos Santos
Os ácidos e bases reagem de maneira diferente entre si e possuem comportamentos muito diferentes de outros tipos de substâncias. Para compreendê-los melhor foram criados várias teorias ácido-base, sendo as principais as de Arrhenius, Bronsted-Løwry e de Lewis.
Teoria de Arrhenius
Arrhenius propôs em 1887 uma teoria ácido-base em que, em solução aquosa, qualquer substância que produza cátion hidrogênio (H+) é um ácido e qualquer substância que produza hidroxila (OH-) nas mesmas condições é uma base.
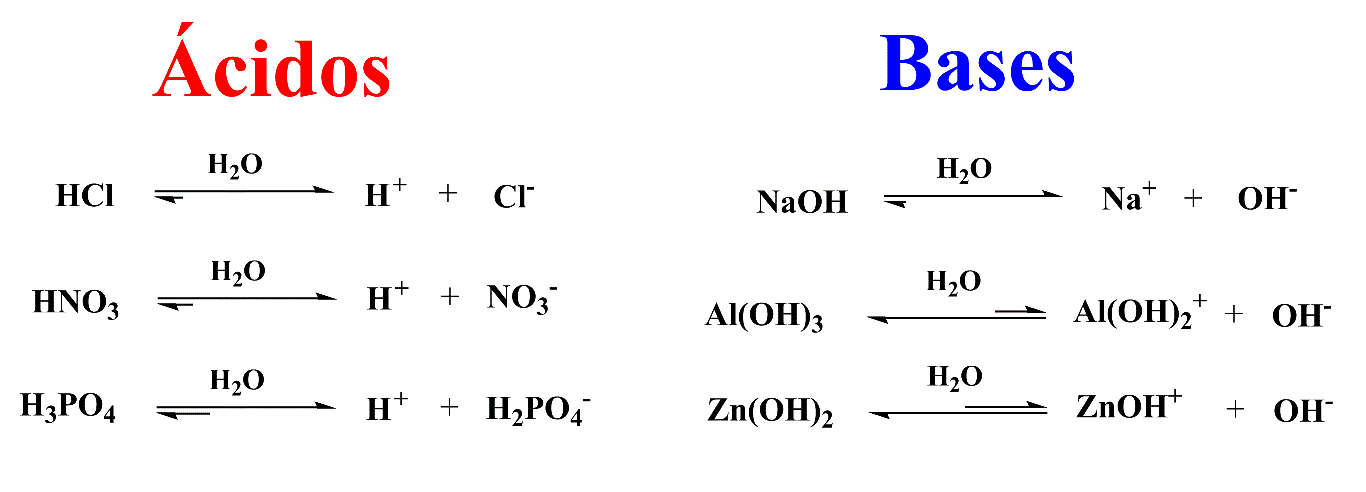
Esquema 1 - Reações de formação de prótons e hidroxilas para ácidos e bases de Arrhenius, respectivamente
Se deseja saber mais detalhes sobre a Teoria de Arrhenius clique aqui.
Teoria de Brønsted-Lowry
Em 1923, foi proposta uma nova teoria ácido-base simultaneamente por Johannes Nicolaus Brønsted, Thomas Martin Lowry e Gilbert Newton Lewis. Nesta teoria, o ácido também é a espécie que gera um íon hidrogênio (próton) como em Arrhenius, mas base passa a ser qualquer substância capaz de receber esse próton e não mais a substância que gera a hidroxila.
No equilíbrio, a base se torna o ácido conjugado e o ácido se torna a base conjugada.
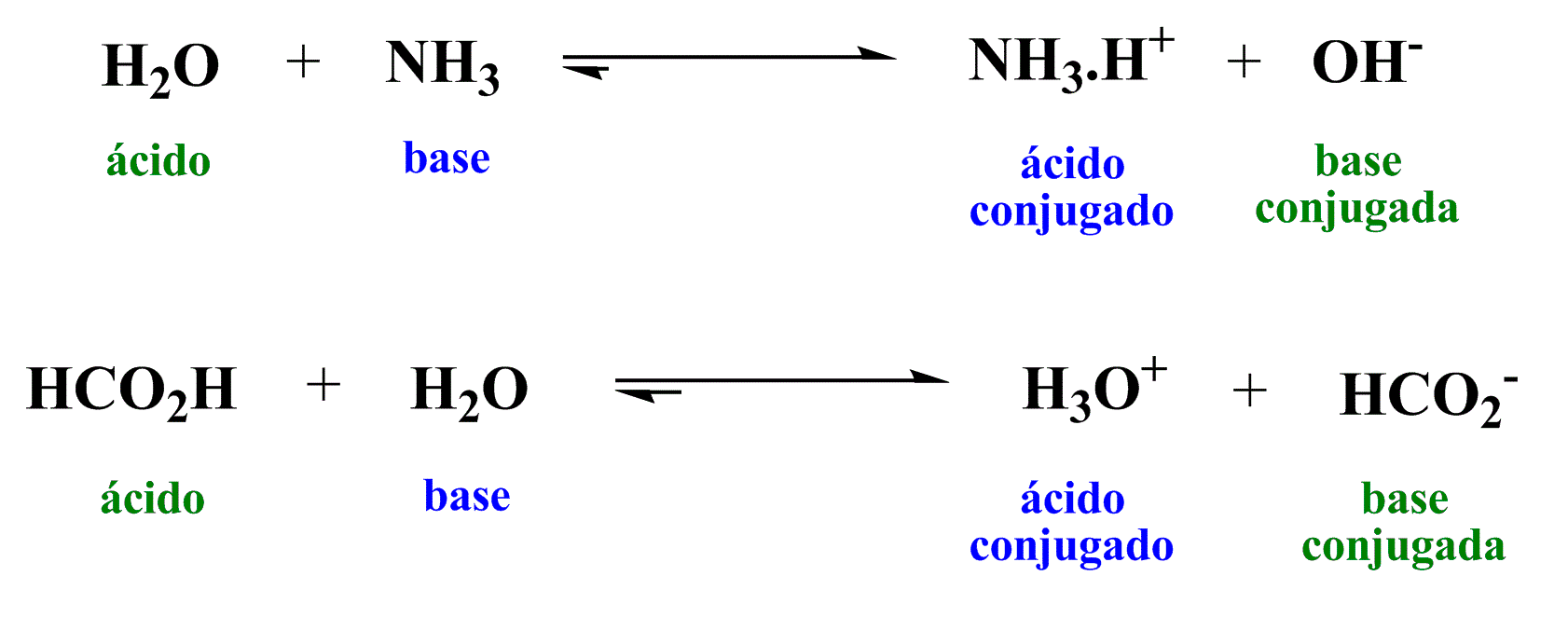
Esquema 2 - Reações ácido-base de Brønsted-Lowry
Se deseja saber mais detalhes sobre a Teoria de Brønsted-Lowry clique aqui.
Teoria de Lewis
Entre 1916 e 1938, Lewis propôs sua teoria ácido base em que o ácido é toda espécie capaz de receber um par de elétrons e base é toda espécie capaz de doar um par de elétrons. Esse conceito é muito mais amplo que a teoria de Brønsted por explicá-la por completo e ir muito mais além.
Base - é a molécula doadora de pares de elétrons. Podem ser pares de elétrons livres ou carga negativa.
Ácido - é a molécula aceptora de pares de elétrons. Podem ser moléculas neutras deficientes em elétrons ou cátions.
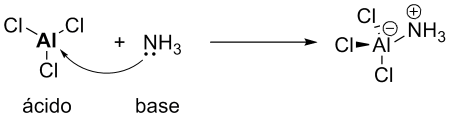
Esquema 3 - Reação de cloreto de alumínio com amônia
Se deseja saber mais detalhes sobre a Teoria de Lewis clique aqui.




