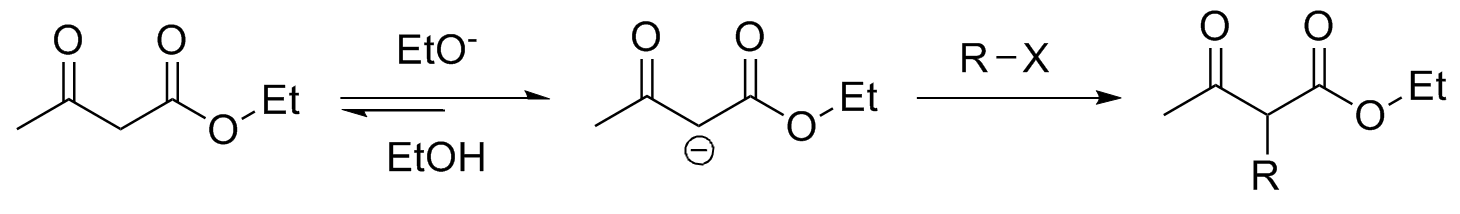
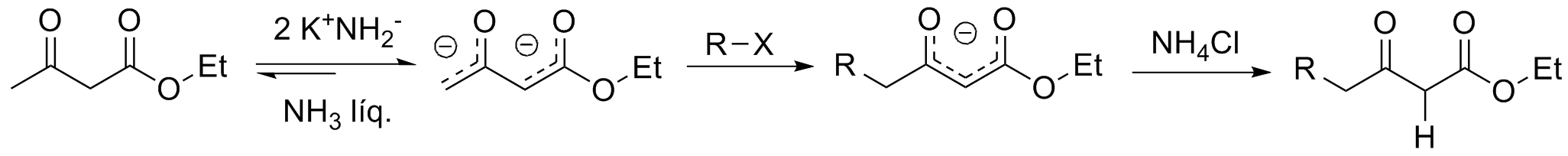O acetoacetato de etila (éster acetoacético) possui um hidrogênio relativamente ácido que é bem estabilizado por ressonância; isso significado que o enolato pode ser usado para formar ligações C-C. Como as reações ocorrem por substituição nucleofílica (SN2) o uso de haletos de alquila primários fornecem melhores rendimentos. Haletos terciários levam apenas à eliminação.
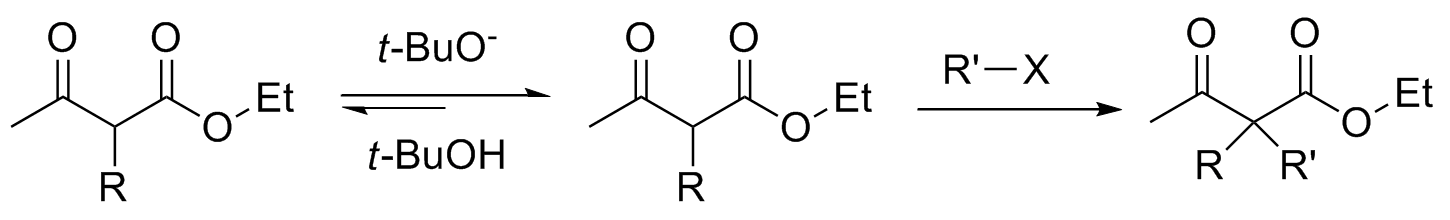
Uma segunda substituição ainda pode ocorrer, mas como o segundo hidrogênio é menos ácido que o primeiro é necessário utilizar uma base mais forte como o t-BuOK. Isso permite selecionar os substituintes que farão a ligação C-C.
Para obter, ao invés do acetoacetato de acetila substituído, uma metilacetona monossubstituída é necessário realizar uma etapa de descarboxilação:
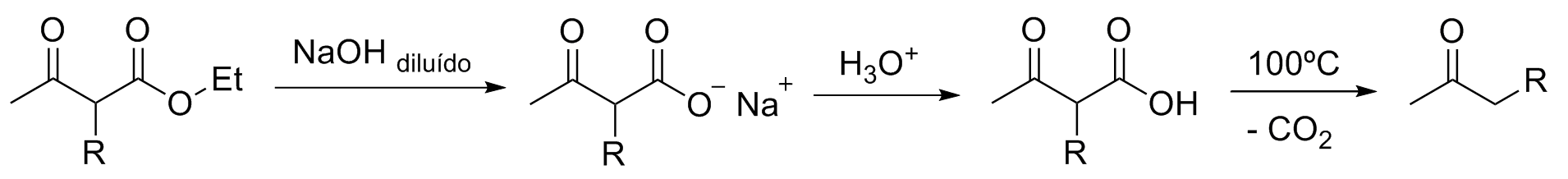
Se for desejado uma metilcetona dissubstituída basta utilizar um acetoacetato de acetila dissubstituído como substrato.
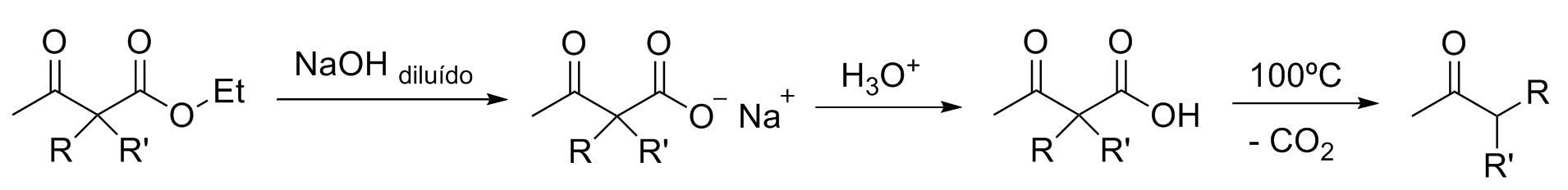
O uso do acetoacetato de atila em relação a acetona se justifica pois o primeiro possui hidrogênio muito mais ácido (pKa 9-11 x pKa 19-20), além de permitir maior controle na seleção dos substituintes. A formação do enolato de acetona exige bases mais fortes e condições especiais.
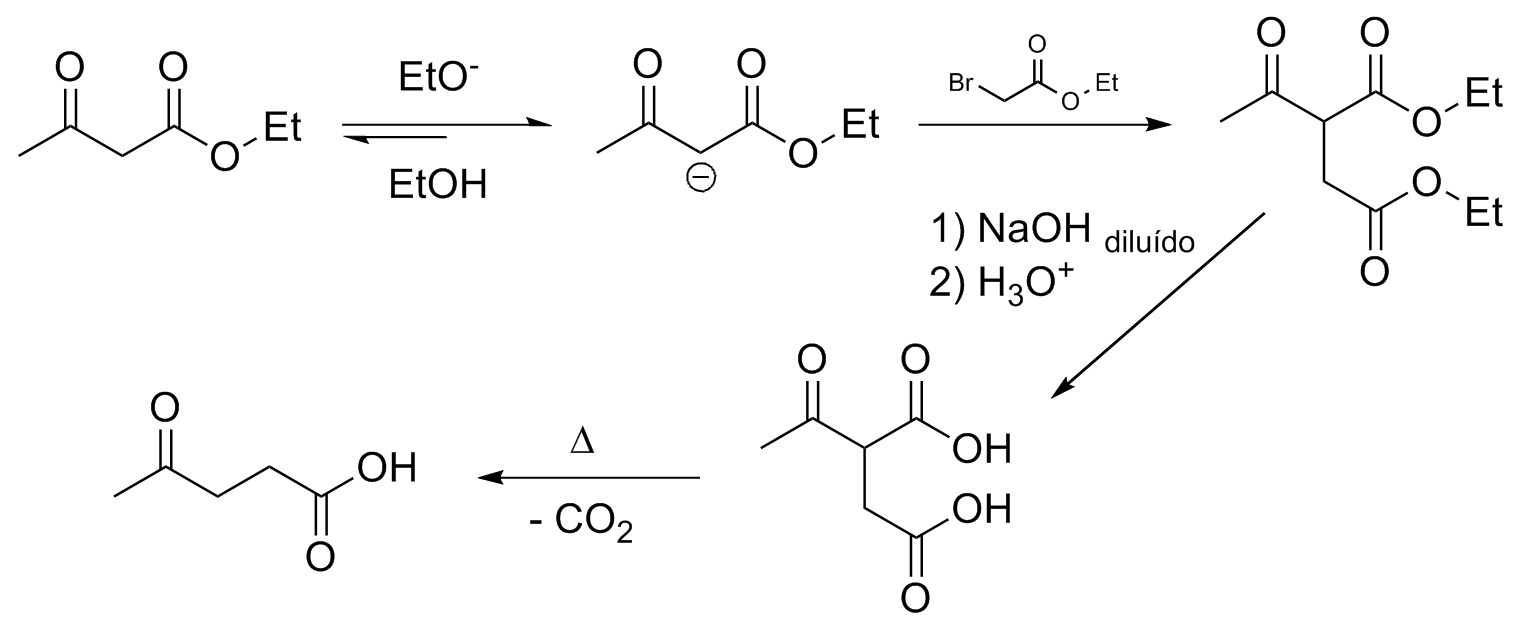
A obtenção de γ-cetoácidos é possível pelo uso de α-haloésteres seguindo as condições já apresentadas, enquanto que o uso de uma α-halocetona levará a uma γ-dicetona.
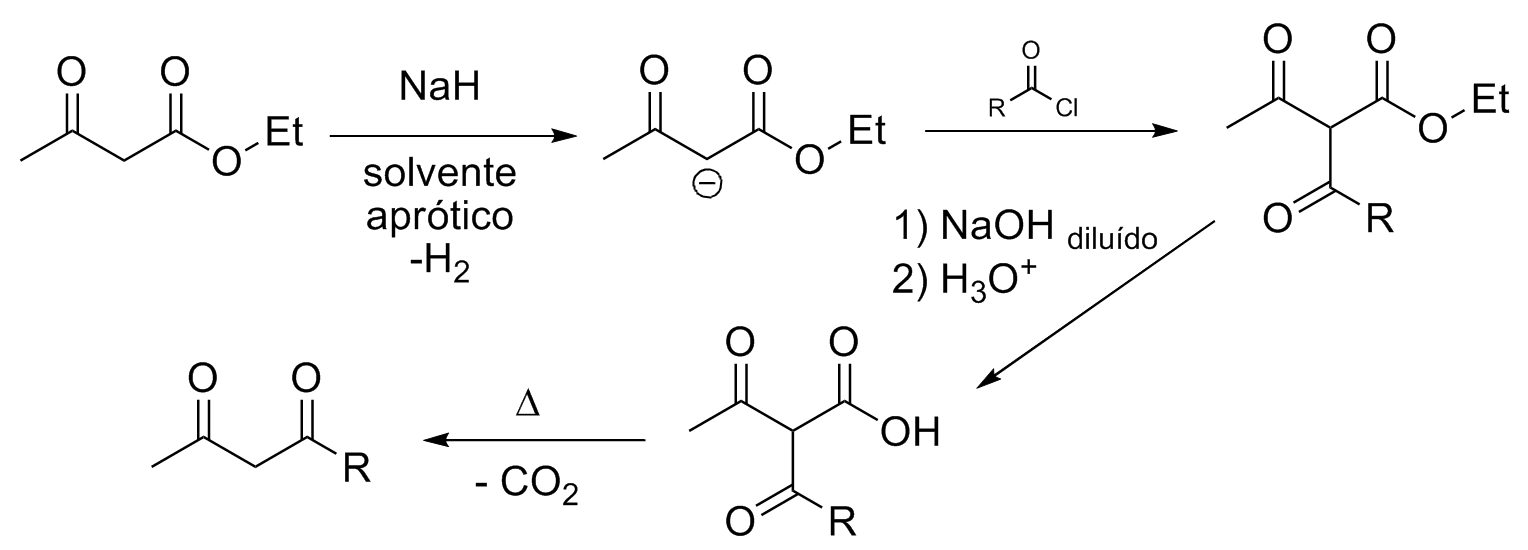
A obtenção de β-dicetonas pode ocorrer utilizando anidridos ou cloretos de acila. Por esse motivo não é possível utilizar o alcóxido como base, pois formaria rapidamente o éster. O solvente deve ser polar aprótico e nessas condições um hidreto metálico é capaz de atuar como base forte.
A alquilação do carbono terminal do acetoacetato de etila exige a formação do diânion que, naturalmente, é formado apenas por uma base muito forte. O uso de dois equivalentes de amideto de potássio leva à substituição cinética.