Aminas Alifáticas
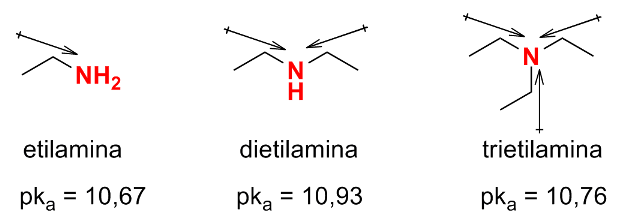
As aminas possuem um par de elétrons não ligantes no nitrogênio que as confere basicidade de Brønsted e de Lewis. Ao ser protonada, a amina se torna um cátion amônio que pode ser estabilizado por grupos doadores de densidade eletrônica por indução, geralmente grupos alquila. Assim, aminas terciárias são mais básicas que secundárias e primárias.
NR3 > -NHR > -NH2 > NH3
Como os valores de pKa são obtidos em água, as aminas secundárias são melhor solvatadas que as terciárias causando uma pequena variação na tendência esperada.
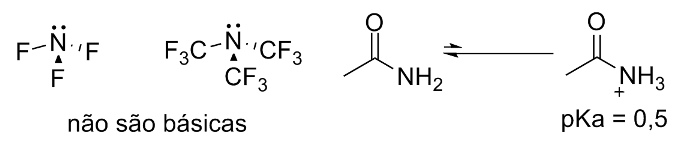
Se um grupo retirador de elétrons estiver ligado ao grupo -NH2 como ocorre em amidas, a basicidade do nitrogênio é prontamente suprimida:
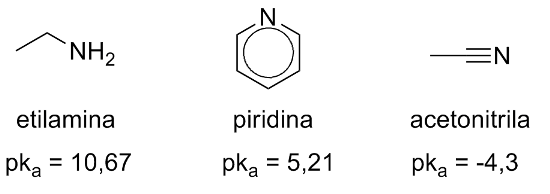
A hibridização também afeta a basicidade do nitrogênio: quanto maior o carácter s, menor a basicidade:
N sp3 > N sp2 > N sp
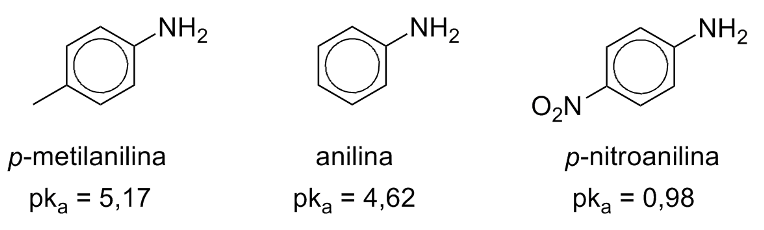
Aminas Aromáticas
Em aminas aromáticas o par de elétrons do nitrogênio está pouco disponível, o que as torna menos básicas que as alifáticas.
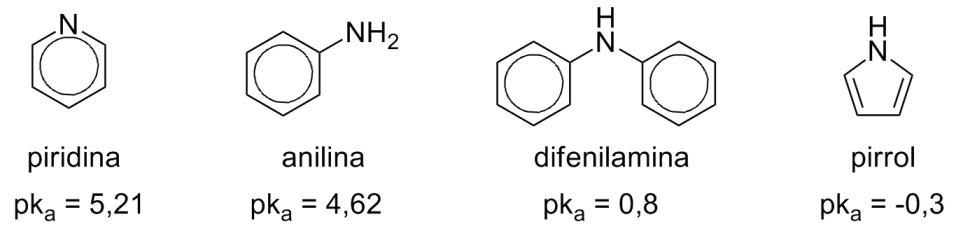
Grupos retiradores de elétrons prejudicam ainda mais a basicidade de aminas aromáticas por desestabilizar o ácido conjugado carregado positivamente, enquanto que doadores de densidade eletrônica atuam no sentido inverso.