Haletos de hidrogênio podem reagir com alcenos para formar haletos de alquila/ arila:
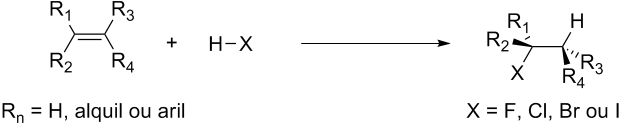
A ordem de reatividade para os haletos é HI > HBr >> HCl > HF, exatamente a esperada numa reação ácido-base. As reações com HF e HCl costumam ser muito lentas a ponto de serem inviáveis em muitos casos. Os alcenos mais substituídos reagem mais rápido do que os menos substituídos.
Quando a reação ocorre em um alceno assimétrico podem ser formados dois produtos, mas a proporção não é idêntica: o haleto secundário é o produto majoritário.

Regra de Markovnikov
Após analisar várias reações com o mesmo comportamento Vladimir Markovnikov (1870) enunciou a Regra de Markovnikov:

Ou seja, o halogênio será adicionado ao carbono mais substituído. Quando as reações de adição seguem essa regra são chamadas de Adições Markovnikov.
Outros exemplos de adições Markovnikov:
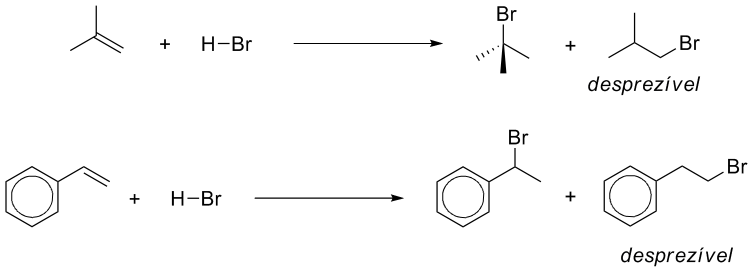
Mecanismo da Adição de Markovnikov
Como são formados dois produtos diferentes a partir do mesmo substrato trata-se de uma reação competitiva, logo o controle é cinético. No controle cinético a proporção de produtos é definida pela maior velocidade de reação, consequentemente pela menor Ea.
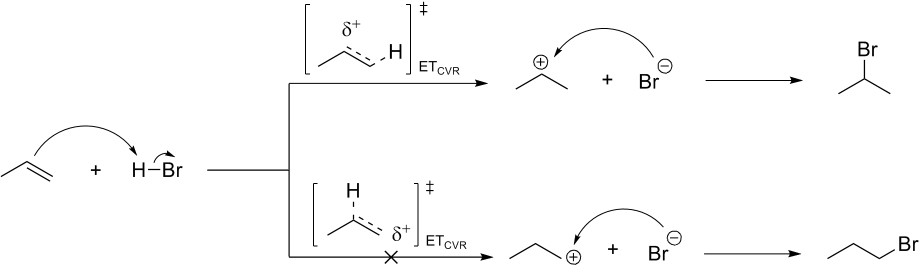
A formação do carbênio primário exige maior Ea para ocorrer, assim a formação do intermediário carbênio secundário é mais rápida e leva à formação do produto Markovnikov. Após a formação da ligação C-X a reação é irreversível, portanto o controle cinético dos produtos se mantém mesmo que houver aumento de temperatura.
Exceção à Regra de Markovnikov
A Regra de Markovnikov é válida para reações polares, mas em reações radicalares com HBr ocorre a inversão da proporção de produtos. Isso não ocorre com HF, HCl ou HI e apenas quando o HBr reage na presença de peróxidos orgânicos que são iniciadores de reações radicalares. Nessas condições são obtidos produtos anti-Markovnikov:
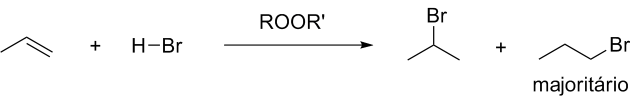
O mecanismo para a Adição anti-Markovnikov é diferente do apresentado para a reação polar, logo as Ea são diferentes e as velocidades relativas de formação de produtos explicam as proporções observadas.
