Ligações Polares e Polaridade
A diferença de eletronegatividade entre os átomos em uma molécula forma o momento dipolo, medido em Debye (D), tornando essa ligação polar: quão maior for o momento dipolo, maior a polaridade da ligação. A geometria da molécula afeta profundamente a polaridade total pois ligações polares simétricas tendem a anular a polaridade total. Por exemplo, no CO2 o carbono faz duas ligações duplas com os oxigênios, que são ligações polares, mas a simetria anula os momentos dipolo da molécula tornado-a apolar. O mesmo ocorre com o CCl4 e SF6, que tem seu momento de dipolo total anulado por simetria. Por outro lado, na H2O as ligações são polares e a soma dos momentos de dipolo torna a molécula polar.

Algumas ligações são tão polares que podem ser rompidas sob certas condições, como o HCl em solução aquosa. Esse processo de ionização é uma reação química que também ocorre com o fenol e com ácidos orgânicos como o ácido acético e ácido benzoico.
Ligação Iônica
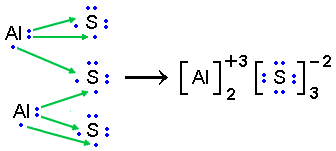
A ligação iônica é uma atração eletrostática que ocorre entre o par positivo (cátion) e negativo (ânion) formados por uma grande diferença de eletronegatividade, geralmente entre metais e ametais.
As substâncias iônicas, ou sais, costumam ter alto ponto de fusão em virtude da alta energia necessária para afastar cargas opostas e conduzem corrente elétrica quando em solução aquosa ou fundidos. Dentre as substâncias iônicas estão NaCl, LiClO4, KOH e (Mg)3(PO4)2, por exemplo
Ligação Covalente
Quando a diferença de eletronegatividade não é grande o suficiente para gerar cargas formais a ligação é dita covalente, ou seja, há compartilhamento dos elétrons da ligação entre os átomos. As moléculas são as substâncias formadas predominantemente (ou totalmente) por ligações covalentes entre seus átomos.
A ligação covalente pode ter cargas parciais entre seus átomos em função de suas eletronegatividades. Para algumas moléculas, como HCl e H2SO4, essas cargas parciais são tão intensas que elas podem reagir com outras moléculas para formar cátions e ânions - sendo portanto moléculas ionizáveis. As moléculas ionizáveis também podem conduzir corrente elétrica se seus íons puderem ser formados de maneira eficiente.
Uma maneira muito simples de representar ligações químicas é através das Estruturas de Lewis:
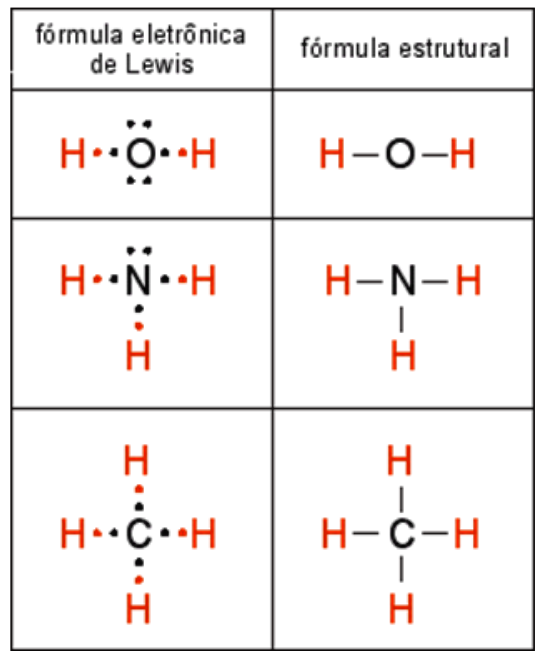
- o número total de elétrons deve ser obtido pela soma dos elétrons de valência nos átomos envolvidos (cada carga negativa conta como um elétron extra, assim como cada carga positiva conta como um elétron a menos);
- o átomo central é aquele que formará mais ligações para completar o octeto (ou para extrapolá-lo);
- os demais átomos se ligam ao átomo central e os elétrons são distribuídos até que seus octetos sejam satisfeitos (elementos como enxofre e fósforo podem exceder o octeto por possuírem orbitais d hibridizáveis como em SF6 e PCl5), observando suas cargas parciais;
- ânions devem ser representados com um elétron extra, assim como cátions devem possuir um elétron a menos.