Entre 1916 e 1938, Lewis publicou alguns trabalhos que culminaram na sua proposta de uma nova teoria ácido base. Em sua teoria, o ácido é toda espécie capaz de receber um par de elétrons e base é toda espécie capaz de doar um par de elétrons. Esse conceito é muito mais amplo que a teoria de Brønsted por explicá-la por completo e ir muito mais além.
A partir da teoria ácido-base de Lewis todas as reações orgânicas polares podem ser compreendidas, além das interações entre cátions metálicos e substâncias orgânicas.
Base - é a molécula doadora de pares de elétrons.
Ácido - é a molécula aceptora de pares de elétrons.

Alguns outros exemplos:
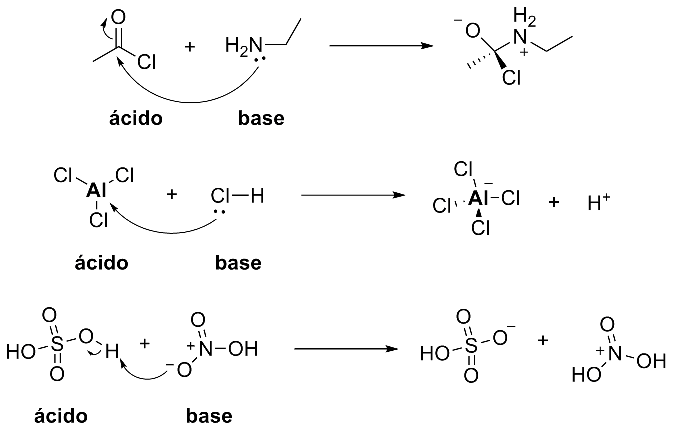
Os ácidos de Lewis são espécies que possuem deficiência eletrônica, seja por carga parcial via efeito indutivo ou por possuir carga positiva formal. Da mesma forma, as bases são espécies que podem doar o par de elétrons por possuir carga negativa formal, carga negativa parcial ou por possuírem par de elétrons n compartilháveis. Essa análise é de fundamental importância para definir quais moléculas são mais ácidas e mais básicas no meio reacional, definindo assim a sequencia de reações mais favorável.
