As forças intermoleculares são forças atrativas baseadas nos dipolos elétricos das ligações químicas. Em função da intensidade existem três forças intermoleculares principais:
Dipolo Momentâneo ou Dispersão de London
Os elétrons em uma ligação não ficam parados em uma posição intermediária entre os núcleos de uma ligação, mesmo em moléculas com momento dipolo nulo como o Br2, mas se deslocam continuamente entre esses núcleos. Esse deslocamento pode concentrar densidade eletrônica em um dos núcleos e formar um dipolo momentâneo. Esse dipolo momentâneo acaba induzindo outros dipolos nas moléculas próximas e como efeito geral ocorre uma atração entre as moléculas do Br2.
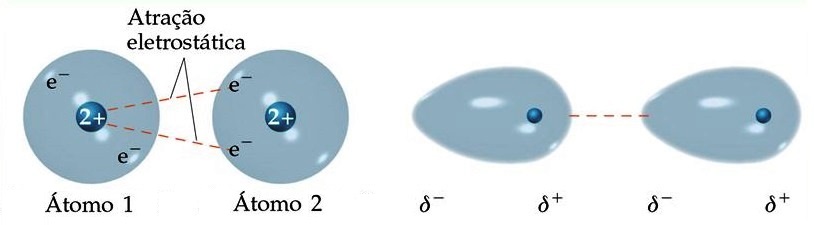
Como os dipolos são de pequena intensidade e duram pequenos períodos de tempo a força atrativa dessa interação é baixa. Em moléculas com pequeno momento dipolo esse efeito se torna um pouco mais pronunciado, como em moléculas com apenas carbono e hidrogênio. Em moléculas com grande área superficial esse efeito fica ainda mais pronunciado, sendo importante em materiais como polímeros.
Dipolo Permanente ou Dipolo-dipolo
A densidade de probabilidade é a medida da probabilidade do elétron se encontrar em determinado intervalo de espaço. A aplicação desse conceito às funções de onda do elétron permite descrever tridimensionalmente os orbitais atômicos:
Ligação de Hidrogênio
A ligação de hidrogênio é um tipo especial de dipolo permanente em que moléculas que tenham hidrogênios ligados aos átomos eletronegativos flúor, oxigênio e nitrogênio exibem um dipolo tão intenso que leva a características diferenciadas nessas moléculas. Apesar dessa interação possuir energia inferior a ligação covalente, é a mais forte das interações intermoleculares e explica, por exemplo, porque H2O é líquida a temperatura ambiente.
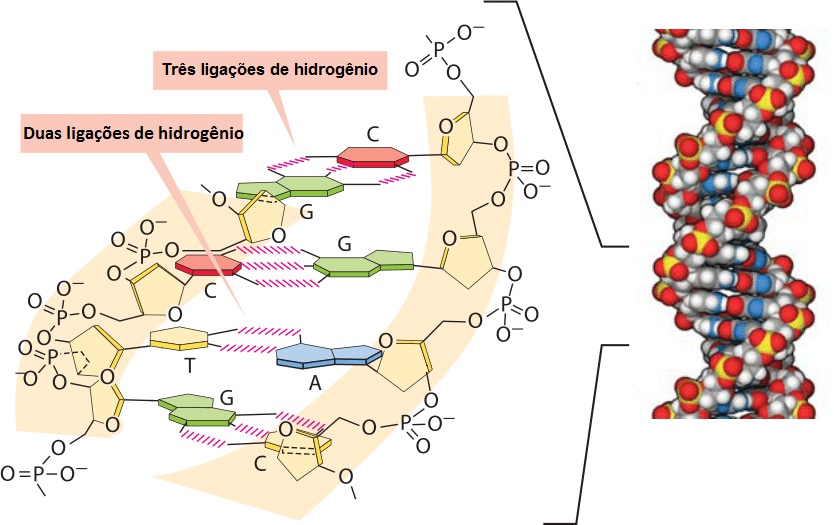
Outra importante função da ligação de hidrogênio é a de unir as bases nitrogenadas na molécula de DNA.