Cargas Parciais
Quando um núcleo atrai para si a nuvem eletrônica da ligação química o balanço elétrico em torno deste núcleo é alterado: como há maior concentração de carga negativa esse átomo passar a possuir uma carga parcial negativa (δ-), enquanto que o outro átomo passar a ter uma carga parcial positiva (δ+) de mesma intensidade.
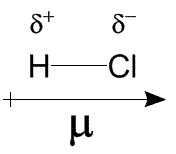
A diferença de eletronegatividade entre dois átomos que dividem uma ligação química forma um dipolo e é representado pelo momento de dipolo (μ) que aponta para o sentido do fluxo eletrônico, ou seja, na direção do elemento mais eletronegativo. No HCl, o momento de dipolo aponta para o cloro que fica com a carga parcial negativa.
Em moleculares não lineares, como a H2O, é necessário estabelecer o momento de dipolo resultante pela soma vetorial dos momentos de dipolo individuais.
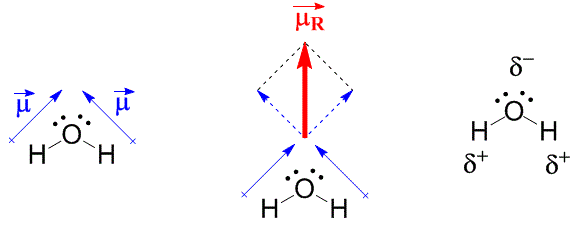
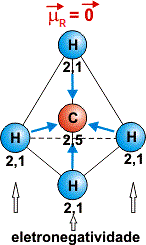
Se o momento dipolo resultante em uma molécula for diferente de zero, essa molécula é polar. Caso seja zero ou muito próximo de zero essa molécula é dita apolar como no CH4.
Cargas Formais
Nos casos em que há grande diferença de eletronegatividade na ligação química a atração de um núcleo pode ser tão forte que esta pode se romper e formar cargas formais.
As cargas formais ocorrem nos átomos pela falta (+) ou excesso (-) de um ou mais pares de elétrons da ligação química. O NaCl possui cargas formais quando é dissolvido em água para formar Na+ e Cl-, assim como o HCl (H+ e Cl-), mas isso não ocorre com a NH3 ou a H2O na mesma proporção.
