Arrhenius propôs em 1887 uma teoria ácido-base que, de maneira simplificada, diz que qualquer substância que em solução aquosa produza cátion hidrogênio é um ácido e qualquer substância que produza hidroxila nas mesmas condições é uma base.
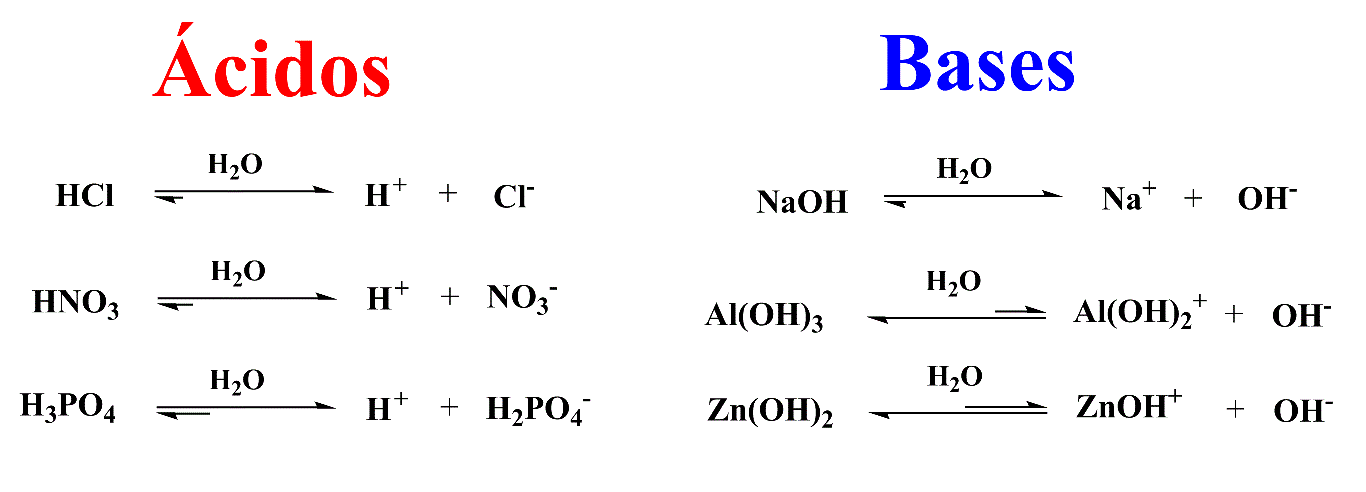
Apesar de ser uma teoria relativamente limitada em química orgânica, é dela que derivam os conceitos de Constante de Acidez (Ka), Potencial Hidrogeniônico (pH) e Escala de pH.
Constante de Acidez
Todo ácido que se dissocia em água possui está sob um equilíbrio denominado constante de acidez (Ka):

Quanto maior for a formação de H3O+, maior o valor de Ka e mais forte é o ácido. Os valores tabelados para Ka são padronizados para o mesmo solvente (a água é o padrão, mas existem outros), mesma temperatura e mesma quantidade inicial de ácido, já que esses parâmetros alteram o equilíbrio.
Os ácidos polipróticos possuem valores de Ka diferentes para cada etapa da ionização, que via de regra são decrescentes.

Os valores de Ka para alguns ácidos:

Um equilíbrio muito importante é o da autoionização da água (Kw):

que nas condições ideais possui valor de Kw = 1,0.10-14 e [H+] = [OH-] = 10-7.
Potencial Hidrogeniônico
Os valores de Ka são, em geral, muito pequenos e difíceis de trabalhar. Para contornar esse inconveniente foi proposto o uso do pKa.

que transforma os valores muito pequenos de Ka em valores positivos e inteiros de pKa. Como é utilizado um logaritmo negativo, quanto menor for o pKa, mais forte será o ácido.
A aplicação do logaritmo negativo a Kw leva à obtenção do potencial hidrogeniônico da água (pH):

Escala de pH
À medida que as substâncias afetam o Kw, diferentes valores para [H+] são possíveis, logo diferentes valores de pH podem ser observados. Assim, foi criada a escala de pH em que o pH = 7 é considerado neutro, valores inferiores a 7 até 0 são obtidos por substâncias mais ácidas que a água e valores superiores a 7 até 14 são substâncias mais alcalinas que a água.
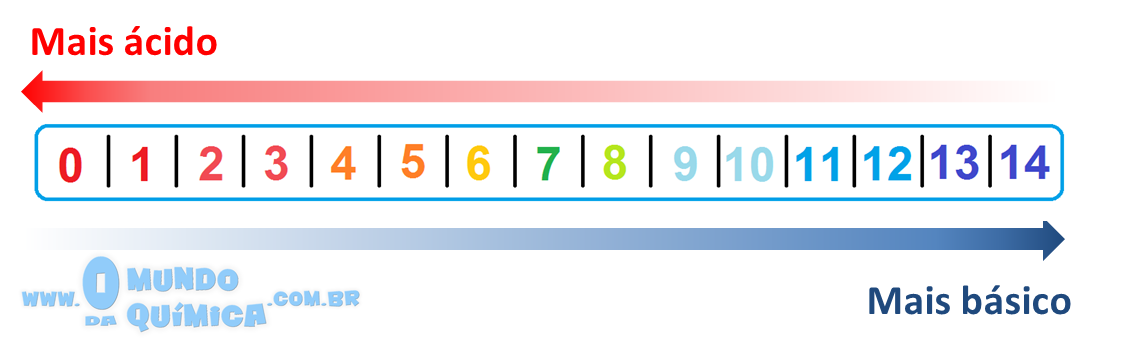
Naturalmente, esses valores são dependentes da solubilidade das substâncias em água. Muitas moléculas orgânicas alteram pouco o pH da água por essa razão.
