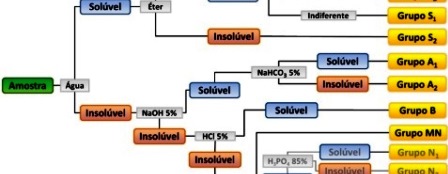
Identificação de Halogênios - Método da Mineralização
A reatividade dos halogêneos varia radicalmente do flúor ao iodo. Alguns compostos iodados decompõe-se quase que espontaneamente para formar I2 enquanto muitos compostos fluorados chegam perto de serem inertes; iodetos, brometos e cloretos terciários, assim como clorados benzílicos e alílicos, reagem prontamente com AgNO3 para formar o respectivo halogeneto de prata; iodetos de modo geral reagem facilmente, mas nem sempre são de fácil detecção, brometos e cloretos podem ser mineralizados mais facilmente e identificados e os fluoradas são difíceis de mineralizar mas nem tanto para identificar.
Diante desse cenário um método para isolar e detectar halogênios é a mineralização, como nos ensaios de Lassaigne e pirólise com CaO.
O ensaio de Lassaigne (1843) utiliza o sódio metálico na pirólise para mineralizar a amostra orgânica e identificar os heteroátomos. É um método universal já que se aplica a enxofre (formando sulfeto ou tiocinato se nitrogênio estiver também presente), nitrogênio (formando cianeto) e os halogênios (formando os halogenetos), além de também identificar fósforo (formando fosfato). Uma única pirólise é suficiente para produzir o licor que será utilizado nos ensaios de identificação dos heteroátomos.
Entretanto, devido aos cuidados no trato com o sódio metálico, que no ensaio deve ser fundido (portanto mais reativo), a eventual falta deste no almoxarifado e a necessidade de trincar o microtubo em água seu uso é evitado. Por esse mesmo motivo sua descrição foi omitida anteriormente em preferência a métodos mais fáceis e seguros.
A pirólise com óxido de cálcio produz resultado semelhante com a vantagem de abolir o sódio metálico, entretanto a necessidade de trincar o microtubo por choque térmico e os tratamentos posteriores não podem ser eliminados.
Esses dois métodos, pirólise com CaO e o de Lassaigne, são os únicos que permitem abrir uma amostra de halogêneos. Contudo é possível dividir os ensaios em três de acordo com as reatividades dos halogêneos: Flúor (Método da mineralização), Cloro e Bromo (Método da Sulfocrômica) e Iodo (Pirólise com areia).
► Identificação de Cloro e Bromo - Método da Sulfocrômica
Interferente - Oxigênio do ar (reagente iodeto-amido)
A combustão úmida com sulfocrômica é bastante útil para identificação de halogênios, exceto o flúor que em geral não reage. Os produtos são CO2, H2O e halogênio molecular.
Apesar de o iodo responder ao teste há alguns problemas quanto à sua identificação por esse método. Se houver excesso de sulfocrômica o iodo molecular passa a ácido iódico que não é volátil, enquanto o cloro e bromo não reagem da mesma forma, formando sempre Cl2 e Br2 independente da proporção de sulfocrômica usada.

Para identificação geral de halogênios pode-se utilizar o reagente brometo-fluoresceína.

A literatura reporta a coloração da eosina (produto de bromação da fluoresceína) como carmim, que é uma cor avermelhada. No entanto o que se percebe na prática é uma coloração rosa intensa. O cloro não reage com a fluoresceína, no entanto, ele oxida o brometo a Br2 presente no reagente brometo-fluoresceína e este reage com a fluoresceína. Se a mostra conter bromo este reage direto com a fluoresceína ignorando o brometo. Adicionalmente, cloro produz um clareamento no centro da mancha rosa, sendo um forte indicativo de sua presença.
O I2 reage analogamente como o bromo com a fluoresceína, resultando na eritrosina que é semelhante a eosina, inclusive na coloração. No entanto a reação é muito mais lenta e, nas condições de análise, não é prático tentar identificar iodo por este método.
Uma vez identificada a presença de halogênio, mesmo com a indicação da permanência do papel de filtro para verificar descoramento ou não é necessário realizar os testes específicos.
Reagente Fluoresceína
Interferentes - Não há
Nas condições de análise reage especificamente com o brometo, formando eosina como coloração rosa.

Reagente de Villier
Interferentes - Não há
Se trata de uma solução de anilina e toluidina que reagem especificamente com o cloro para formar um produto de condensação.

Referências
1 Adaptado de Apostila de Análise Orgânica, CEFET Química Nilópolis, 2005
2 Costa Neto, C.; Análise Orgânica, Métodos e Procedimentos para a Caracterização de Organoquímios, Vol. 1, 4º Edição, Rio de Janeiro: Editora UFRJ, 2004
3 Shriner, Fuson, Curtin e Morrill; Identificação Sistemática dos Compostos Orgânicos, 6º Edição, Rio de Janeiro: Editora Guanabara, 1983