Sabemos que o sabão é muito bom para limpar gorduras, inclusive em roupas. Mas como ele faz isso a nível molecular?
Por Carlos Vinícius Pinto dos Santos

Figura 1 - Barra de sabão comum
O sabão é constituído por moléculas que possuem propriedades especiais. Essa característica permite que o sabão mude um pouco as propriedades da água, quando em solução.
As moléculas de água possuem uma atração mútua muito forte e na superfície essa força é conhecida como tensão superficial, que é uma medida da coesão das moléculas na superfície do líquido. A água tem uma espécie de aderência tão forte entre suas moléculas, que é capaz de suportar pequenos insetos em sua superfície como se formasse uma película. Note que, mesmo que a superfície da água esteja deformada pelo peso, ela não se rompeu.

Figura 2 - Insetos leves são capazes de pousar na água graças à tensão superficial
Os tensoativos são um grupo de substâncias que alteram a tensão superficial de solventes, notadamente a água, e o sabão é o exemplo de uso mais generalizado. Os tensoativos alteram a coesão das moléculas da superfície, de modo que água com sabão poderia já não ser capaz de suportar esse mosquito. Contudo, o sabão não elimina a tensão superficial da água. A diminuição da tensão superficial acontece devido à estrutura molecular do sabão:
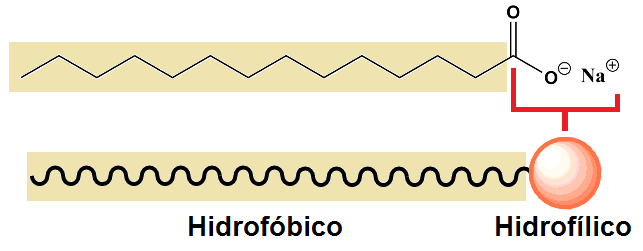
Figura 3 - Cabeça polar e cauda apolar no sabão
O sabão nada mais é do que um sal de ácido graxo - o sabão é fabricado a partir de óleos e gorduras. Está dividido em uma parte hidrofílica e outra hidrofóbica. O termo hidrofóbico se refere a algo que não tem afinidade por água, enquanto que hidrofílico tem afinidade por água. Ao ser dissolvido em água esta passa a fazer interações com as cargas do sabão que se formam. Porém, a água interage apenas com a parte que possui carga, mas não com o resto da molécula, restando .duas alternativas para a cauda carbônica: interagir com as paredes do recipiente ou ficar (preferencialmente) fora da água - que é justamente quando ocorre o enfraquecimento da tensão superficial.
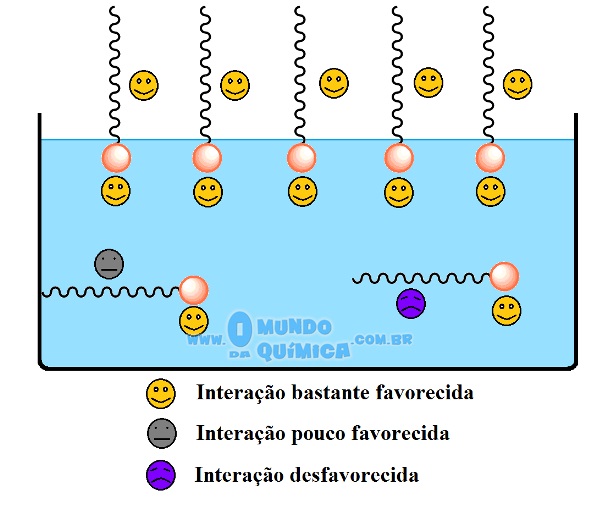
Figura 4 - Tipos de interação do sabão em líquido polar (água)
Como as cadeias carbônicas apresentam poucas interações entre si ou são muito fracas, a coesão diminui à medida que a superfície tem mais moléculas de sabão. Ou seja, a tensão superficial diminui com o sabão. Quando não há mais espaço na superfície, a tendência é a interação ocorrer com as paredes do recipiente.
Se o líquido for apolar, como o óleo, o fenômeno é idêntico, porém invertido. A cadeia carbônica tende a ficar no óleo e a parte iônica ocupa a superfície.
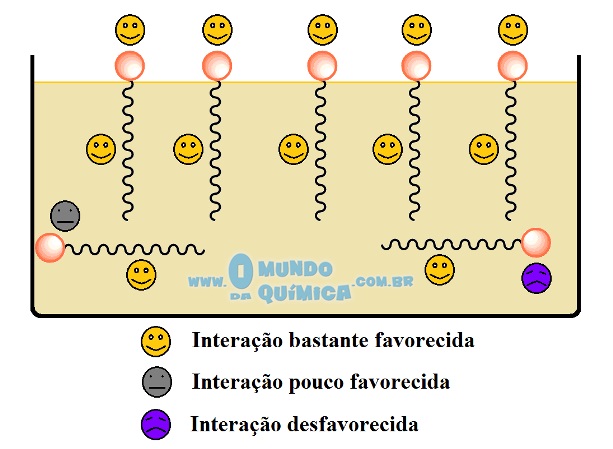
Figura 5 - Tipos de interação do sabão em líquido apolar (querosene)
Essa característica faz com que a água com sabão tenha um comportamento muito importante: ela "molha" melhor que a água pura. Você já deve ter percebido que, ao deixar uma gota de água cair sobre um tecido, ela fica como uma bolinha sobre a trama do tecido por um tempo. Isso ocorre pela tensão superficial da água que a impede de penetrar pela trama imediatamente. Experimente fazer o mesmo teste com água e sabão e veja a diferença.
Agora, imagine que fosse adicionado cada vez mais sabão na água. Depois da superfície estar totalmente povoada ocorrerá o povoamento das paredes do recipiente. Daí em diante, qualquer molécula adicional será incluída no seio da solução. A medida que mais moléculas puderem ser adicionadas, elas eventualmente se encontram no seio da solução e, como a cauda carbônica não interage bem com a água, elas podem interagir entre si. Assim, se forma uma estrutura conhecida como micela.

Figura 6 - Ilustração de micela de óleo em água
E é assim que o sabão limpa as coisas. Ao encontrar a gordura, com a ajuda de agitação para acelerar o processo, o sabão pode formar uma micela em torno dela e formar uma partícula que é estável na água, apesar de grande parte dela ser hidrofóbica. Dessa maneira, a água com sabão é capaz de "solubilizar" uma gama de compostos muito maior que a água pura, justamente porque o sabão permite compatibilizar em água moléculas apolares.
Referências
Tensoativos: química, propriedades e aplicações, Decio Daltin, Ed. Edgar Blücher, 2012
