Em 1916, Gilbert Newton Lewis publicou um artigo intitulado “The Atom and the Molecule”1 em que discorre sobre conceitos de polaridade, eletronegatividade e ligação química, dentre outros. No capítulo sobre Estrutura Molecular (página 774) ele explica as ligações químicas entre elementos representativos introduzindo o conceito de elétrons de valência compartilhados e a notação de fórmula eletrônica, que hoje leva seu nome.
Entretanto, o químico estadunidense Irving Langmuir publicou um artigo em 1919 intitulado "The Arrangement of Electrons in Atoms and Molecules"2 em que introduziu o conceito de ligação covalente. Em 1921, publicou "The Crystal Structures of the Ammonium Halides Above and Below the Transition Temperatures"3 em que analisou cristais através de haletos de amônio por difração de raios-X (método de Hull4,5), corroborando sua descrição anterior sobre ligações químicas. Mesmo citando Lewis em seu primeiro artigo, a ideia de elétrons compartilhados (de onde cunhou o termo co-valente) foi atribuído somente a Langmuir pelo fato de seus artigos terem sido mais recentes e pelas melhorias propostas às ideias originais de Lewis6.
Desejoso de recuperar seu crédito pelo conceito, Lewis escreveu em 1923 a monografia "Valence and the Structure of Atoms and Molecules"7 em que apresentou conceitos diversos como estrutura atômica, periodicidade, os estudos iniciais da época sobre Mecânica Quântica e teorias de ligação química.
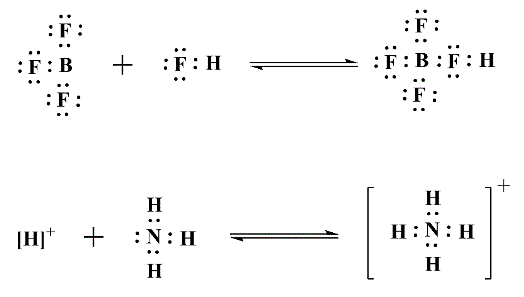
No Capítulo VIII - "Exceptions of the Rule of Eight" ("Exceções da Regra do Octeto"), ele discorre sobre seu conceito de transferência de pares eletrônicos sem, no entanto, se referir claramente como um sistema ácido-base. Os exemplos abaixo seguem a representação original e é possível notar que sua teoria eletrônica já incorporava inclusive a Teoria Protônica. Assim, os fundamentos do novo conceito estavam lançados.
Finalmente, em 1938 Lewis publica seu artigo "Acids and Bases"8 onde, referenciando sua monografia de 19237, definiu que:
Base - é a molécula que tem um par de elétrons disponível, que pode ser fornecido à camada de valência de outro átomo;
Ácido - é a molécula capaz de receber tal par de elétrons em sua camada de valência.
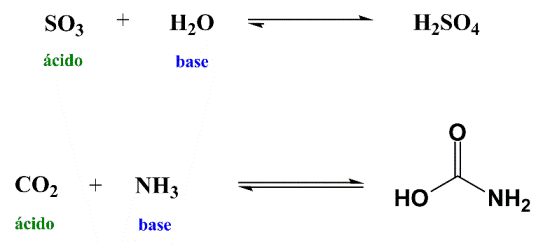
Dessa maneira, Lewis generalizou tremendamente o conceito ácido-base, em que reações de oxirredução e coordenação podem ser incluídas nesse modelo como reações ácido-base. Em 1927 Sidwick9 introduz o conceito de molécula doadora e aceptora de pares de elétrons, e Lewis reconhece a coincidência com seu conceito de ácido e base, de modo que:
Base - é a molécula doadora de pares de elétrons.
Ácido - é a molécula aceptora de pares de elétrons.
Quando duas moléculas neutras se combinam, sendo uma ácida e outra básica, uma tensão elétrica é produzida. É necessário que haja um rearranjo molecular para aliciar as tensões formadas, onde geralmente o hidrogênio é transferido para algum oxigênio.
Em seguida, elencou os seguintes critérios fenomenológicos como mais importantes no comportamento ácido-base:
I. Quando um ácido e uma base podem se combinar, o processo de combinação, ou neutralização, é rápido.
II. Um ácido ou base pode deslocar de seus compostos ácidos ou bases mais fracos.
III. Ácidos e bases podem ser titulados um contra o outro através de substâncias, normalmente coloridas, conhecidas como indicadores.
IV. Ambos, ácidos e bases, desempenham papéis extremamente importantes como catalisadores na promoção de processos químicos.

Assim, o conceito eletrônico de Lewis é mais abrangente que os conceitos anteriores de Arrhenius e Brønsted-Lowry, portanto seria o mais adequado. Entretanto, as outras teorias continuam tendo validade e podem ser utilizadas dentro de suas limitações. Em estudos sobre fenômenos aquosos, a teoria de Arrhenius funciona muito bem e pode ser utilizada preterindo a de Lewis, enquanto que, o estudo de algumas reações pelo modelo de ácidos e bases conjugadas de Brønsted pode ser mais intuitivo do que pelo modelo de Lewis.
Referências
1 LEWIS, G. N.; The Atom and the Molecule, J. Am. Chem. Soc., Vol. 38, Nº 4, pag. 762-785
2 LANGMUIR, I.; The Arrangement of Electrons in Atoms and Molecules, J. Am. Chem. Soc., Vol. 41, Nº 6, pag. 868-934
3 BARTLETT, G.; LANGMUIR, I.; The Crystal Structures of the Ammonium Halides Above and Below the Transition Temperatures, J. Am. Chem. Soc., Vol. 43, Nº 1, pag. 84-91
4 HULL, A., W.; A New Method of X-Ray Crystal Analysis, Physics Reviews, Vol.10, Nº 6, pag. 661-696
5 HULL, A., W.; A New Method of Chemical Analysis , J. Am. Chem. Soc., Vol. 41, Nº 8, pag.1168-1175
7 LEWIS, G. N.; Valence and the Structure of Atoms and Molecules, American Chemical Society Monography Series, Nº 4, pag. 142
8 LEWIS, G. N.; Acids and Bases, Journal of the Franklin Institute, Vol. 226, Nº 3, pag. 293-313
9 SIDGWICK, N. V.; The Electronic Theory of Valency, Oxford University Press, pag. 116