John Dalton foi um químico inglês que se dedicou, mais notavelmente, ao estudo dos gases1. Também foi o primeiro a pesquisar a disfunção visual de percepção de cores, da qual sofria, mais tarde conhecida como daltonismo em sua homenagem1,2. Em 1801 descreveu sua Lei das Pressões Parciais3 em que, numa mistura de gases, cada componente exerce pressão independentemente da presença de outros gases. Esses resultados foram base para diversas pesquisas posteriores, incluindo as que lhe dariam suporte para traçar suas teorias mais avançadas.
Continuando as pesquisas com gases, publicou em 1803 “On the absorption of gases by water and other liquids”4, onde apresenta 15 hipóteses de fenômenos de absorção de gases pela água e os resultados dos testes dessas hipóteses. Identificou diferentes afinidades dos gases estudados pela água, que foram divididos em cinco classes, com afinidades decrescentes:

Willian Henry5 estudava fenômenos semelhantes à época e, segundo Dalton, seus resultados levavam ambos a conclusões muito próximas. Dalton concluiu que os fenômenos de absorção, quando incluía variações de pressão (total ou parcial), era de natureza mecânica ao invés de química, influenciando o equilíbrio entre o gás dissolvido e o não-dissolvido. A parte química do fenômeno é a natureza intrínseca da molécula, de modo que, um gás da 1º classe era muito mais difícil de ser removido da água e mais facilmente absorvido do que outro das demais classes, mas sem alterar a proporção de absorção de outros gases. A exceção ocorre se um gás for dissolvido em água que já contenha outro gás, e se os gases tiverem afinidade mútua, a absorção do último é incrementada em relação à absorção pela água pura.
A partir desses resultados, Dalton formulou sua Teoria da Absorção de Gases pela Água2, que tem como parâmetros (como no original):
“1. Todos os gases que entrarem em contato com a água, ou outro líquido, por meio de pressão e que forem totalmente recuperados pela remoção dessa pressão são mecanicamente misturados com o líquido e não quimicamente combinados com ele.
2. Gases misturados à água mantém sua elasticidade e força repulsiva entre suas próprias partículas, sendo as mesmas na água ou fora dela, sendo que a água não possui qualquer outra influência a esse respeito do que um mero vácuo [meio inerte].
3. Cada gás é retido na água pela pressão de gás que sua própria natureza imprime em uma superfície abstratamente considerada, nenhum outro gás que esteja misturado tem qualquer influência permanente nesse contexto.
4. Quando água absorve um gás, como o gás carbônico, este não realiza pressão sobre a água, mas a realiza sobre o recipiente como se não houvesse água ali.
Quando água absorve a quantidade apropriada de oxigênio, que é 1/27 de seu volume, o gás exterior pressiona a superfície da água com 26/27 desta força, e o gás absorvido com 1/27 dessa força exerce pressão sobre o recipiente e não sobre a água. Com nitrogênio e hidrogênio as proporções são 63/64 e 1/63, respectivamente. Quando a água não contém nenhum gás, sua superfície deve suportar toda a compressão de qualquer gás admitido, mesmo que esse gás, em parte, tenha tido sua absorção forçada.
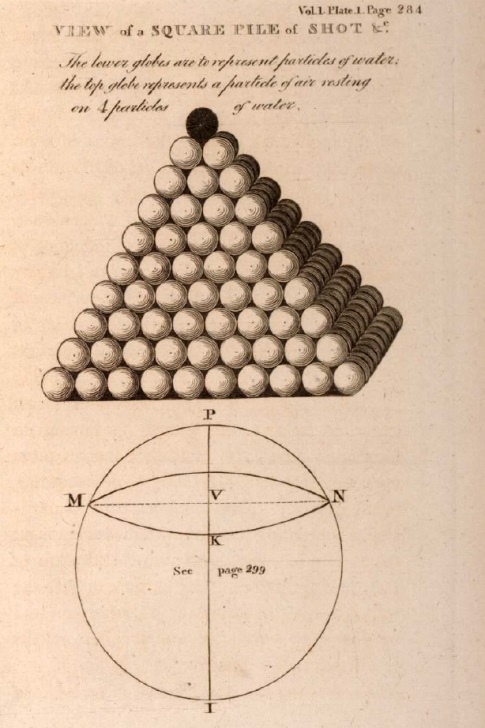
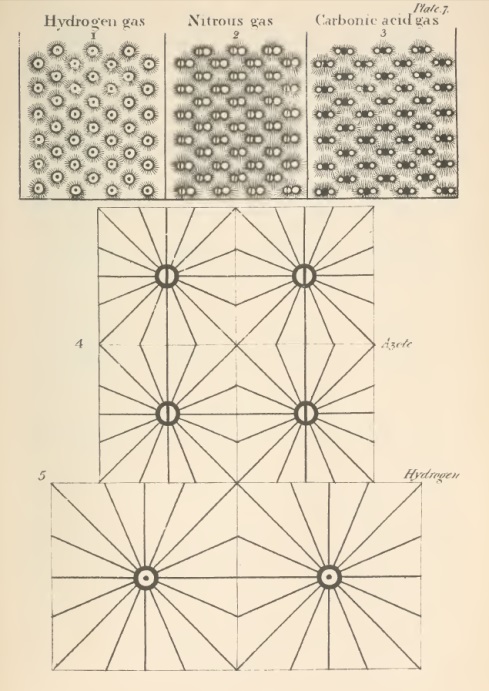
5. Uma partícula de gás pressionando a superfície da água é análoga a uma pressão sobre o topo de uma pilha de quadrados. Como o ponto de contato distribui a pressão igualmente a todos os quadrados abaixo, a partícula de gás distribui a pressão igualmente a cada plano horizontal de partículas de água abaixo até que se atinja a esfera de influência de outra partícula de gás. Por exemplo, um gás qualquer realizando pressão sobre a superfície da água, onde a distância mútua das partículas de gás com as de água seja de 10 para 1; cada partícula de gás divide sua força igualmente por 100 partículas de água, como segue: - Isso exerce imediatamente força sobre 4 partículas de água; essas 4 sobre 9 abaixo, essas 9 sobre 16, e por diante de acordo com a ordem dos números quadráticos, até 100 partículas de água tem a força distribuída entre elas; e na mesma camada quadrada de 100, a água uniformemente comprimida pelo gás, e consequentemente não tem seu equilíbrio perturbado pela pressão.

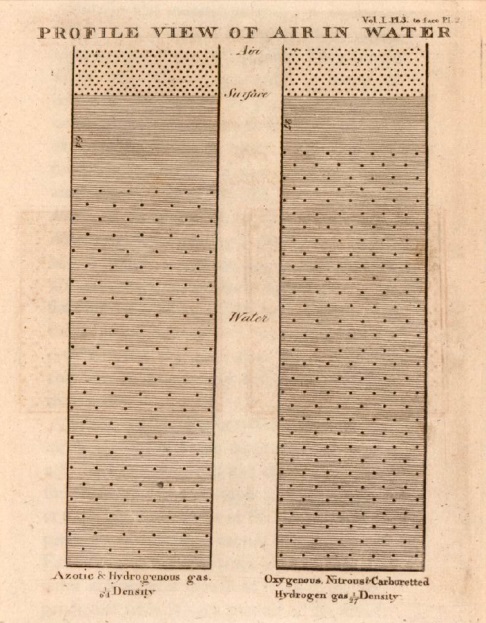
6. Quando água absorve 1/27 de seu volume de qualquer gás, a camada de gás na superfície da água comprime com 26/27 de sua força na água, como indicado na descrição anterior, e com 1/27 dessa força na camada superior de gás na água: a distância de duas camadas de gás deve ser próxima a 27 vezes a distância das partículas na atmosfera e 9 vezes a distância das partículas em água. Essa distância relativamente grande entre o gás absorvido e o externo chama atenção para a grande força repulsiva deste último, por causa de sua maior densidade, ou sua apresentação de 9 partículas na superfície para uma outra. Quando 1/64 é absorvido a distância torna-se 64 vezes a distância de duas partículas exteriores da atmosfera, ou 16 vezes que as absorvidas. As ilustrações sobre as camadas perpendicular e horizontal de gás, dentro e fora da água, devem ser suficientes para ilustrar essas posições.
7. Um equilíbrio entre as atmosferas interna e externa [não] pode ser estabelecido em nenhuma outra circunstância do que a distância dessas partículas de uma atmosfera ser o mesmo valor ou um múltiplo; e é provável que esse múltiplo não possa ser maior que 4. Para esse caso a distância dos ambientes interno e externo é tal qual realizar força perpendicular de cada partícula anterior sobre as partículas que estão imediatamente sujeitas a essa influência, fisicamente falando, iguais; e o mesmo pode ser observado da pequena força lateral.
8. A maior dificuldade presenciada pela hipótese mecânica consiste de diferentes gases observando diferentes leis. Por que a água não admite volumes semelhantes a qualquer tipo de gás?
Tenho convenientemente considerado essa questão, entretanto não sou capaz de me satisfazer completamente, estou quase convencido de que esta circunstância depende do peso e do número final de partículas dos vários gases: aquelas cujas partículas são mais leves e simples serem menos absorvíveis do que outras à medida que se tornam mais pesadas e complexas.* Uma averiguação dos pesos relativos das partículas é um assunto, até onde sei, inteiramente novo: tenho realizado ultimamente essa averiguação com notável sucesso. O princípio não pode ser introduzido neste artigo, mas apenas demonstrarei os resultados em anexo, tanto quanto eles parecem ser determinados pelos meus experimentos.
* As experiências sucessivas demonstram essa conjectura a menos provável”

Posteriormente, em 1808 Dalton publica “A New System of Chemical Philosophy”6, um extenso trabalho com 570 páginas que fornece uma coleção de resultados de suas investigações e teorias associadas. Os estudos vão desde temperatura e calor, assim como instrumentos e tabelas usadas em sua medição, à descrição de vários elementos e compostos, com a discussão de suas propriedades e respectivas sínteses.
No capítulo II: “On the constitution of bodies”, seção 4 “On the constitution of solids.”, o corpo sólido é definido como sendo partículas que tem forças repulsivas e atrativas em equilíbrio, de modo que a distância entre as partículas é estável, sendo necessária aplicação de considerável força para movê-las. Também é descrito que o calor é capaz de mudar o estado físico de uma substância entre líquido e sólido, entretanto descreve que não deve haver mudanças no arranjo de suas partículas, apenas em seus tamanhos (hoje sabemos que esta hipótese é incorreta, uma vez que a mudança de estado físico se dá exatamente pela reorganização estrutural). Há comparação entre dureza e resistência de sólidos, como madeira, ferro e vidro. São relatados ainda padrões geométricos de sólidos, sem, no entanto inferir qualquer explicação sobre a multiplicidade de geometrias pelo desconhecimento da formação dos números de ordem. Nesse capítulo os aspectos microscópicos começaram a ser abordados para justificar características macroscópicas.
No capítulo III: “On chemical synthesis”, Dalton começa a definir regras para a arrumação microscópica das substâncias. As partículas no estado elástico (gasoso) estão separadas umas das outras a uma distância muito maior que em outros estados. Seria como se fosse um ponto no centro de uma grande esfera. Outro ponto abordado é que reações químicas não podem criar ou destruir matéria, apenas separar as partículas existentes e juntar a outras que estavam separadas (ideia já existente na Atomística).
Foi identificado que, a partir dos pesos relativos na massa, é possível inferir os pesos relativos das partículas, ou átomos, podendo assim deduzir a massa de compostos a partir do peso das partículas. Assim, há grande importância e vantagem em determinar os pesos relativos das partículas, tanto de corpos simples quanto dos compostos, o número de partículas elementares simples que constituem uma partícula composta, bem como o número de partículas que entram na formação de mais de um composto de partículas.
Se houver dois corpos A e B, os quais estão dispostos para combinar, a ordem em que as combinações ocorrem, a partir dos mais simples:
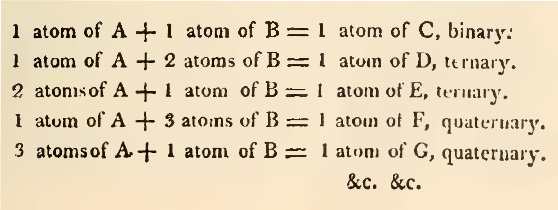
Dalton elaborou as seguintes regras gerais que poderiam ser adotadas como guias a respeito de síntese química (como no original):
“1º. Quando apenas a combinação entre dois corpos pode ser obtida, deve presumir-se que seja um composto binário, a menos que outra causa aponte o contrário.
2º. Quando duas combinações são observadas, deve ser presumido que sejam um composto binário e outro terciário.
3º. Quando três combinações são obtidas, pode-se esperar que um seja um composto binário e os outros dois compostos terciários.
4º. Quando quatro combinações são observadas, devemos esperar que haja um composto binário, dois terciários e um quaternário.
5º. Um composto binário deve ser sempre especificamente mais pesado [mais denso] do que a simples mistura de seus dois precursores.
6º. Um composto terciário deve ser especificamente mais pesado [mais denso] do que a mistura de um composto binário e um simples que, combinados, os constitui.
7º. As regras e as observações acima se aplicam igualmente, quando dois corpos, tais como C e D, D e E, etc são combinados.
A partir da aplicação destas regras, para os fatos químicos já bem apurados, deduzimos as seguintes conclusões:
1º. A água é um composto binário de hidrogênio e oxigênio, e os pesos relativos dos dois átomos elementares são 1 : 7, aproximadamente; [NOTA: a correta proporção entre hidrogênio e oxigênio foi proposta seis anos mais tarde, em 1814, por Berzelius7]
2º. Amoníaco é um composto binário de hidrogênio e nitrogênio e os pesos relativos dos dois átomos são 1 : 5, aproximadamente; [NOTA: a correta proporção entre hidrogênio e nitrogênio foi primeiramente inferida por H. Davy8 em 1810]
3º. O gás nitroso [óxido nitroso] é um composto binário de nitrogênio e oxigênio, os átomos que pesam 5 e 7, respectivamente; o ácido nítrico é uma combinação binária ou terciária uma vez que é um derivado, e consiste de um átomo de nitrogênio e dois de oxigênio, que em conjunto pesam 19; o óxido nitroso [óxido nítrico] é um composto semelhante ao ácido nítrico e consiste de um átomo de oxigênio e dois de nitrogênio, pesando 17; o ácido nitroso é um composto binário de ácido nítrico e de gás nitroso, pesando 31; ácido oxinítrico [ácido nítrico] é um composto binário de ácido nítrico e oxigênio pesando 26;
4º. O óxido carbônico [monóxido de oxigênio] é um composto binário que consiste em um átomo de carbono e um de oxigênio, em conjunto com peso de cerca de 12; ácido carbônico [gás carbônico] é um composto terciário (mas algumas vezes binário) que consiste em um átomo de carbono e dois de oxigênio, como 19 de peso. Em todos estes casos, as massas estão expressas em átomos de hidrogênio, no qual é denotado pelo fator de unidade.”
A partir dessas conclusões, uma série de compostos tiveram suas massas inferidas, mesmo que com as graves imprecisões das medições adotadas à época.
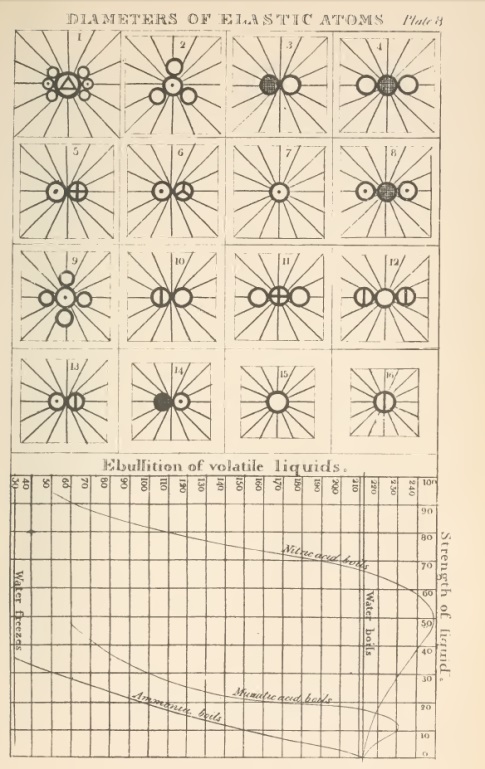
Para representar os elementos ou átomos de compostos, Dalton criou um sistema de símbolos para os elementos, sendo indicados por um pequeno círculo, com alguma marca distintiva e as combinações consistem na justaposição de dois ou mais destes; quando três ou mais partículas são combinados em conjunto em um, é de supor que as partículas do mesmo tipo repelem-se mutuamente e, por conseguinte, toma suas posições no arranjo final.

Referências
3 DALTON, J.; New theory of the constitution of mixed aeriform fluids, and particularly of the atmosphere, A Journal of Natural Philosophy, Chemistry and the Arts, Vol. 5, pag 241-244
4 DALTON, J.; On the absorption of gases by water and other liquids, Manchester, Vol. 1, pag 3-19
5 HENRY, W.; Experiments on the Quantity of Gases Absorbed by Water, at Different Temperatures, and under Different Pressures, Philosophical Transactions, Vol. 93, pag 29-274
6 DALTON, J.; A new system of chemical philosophy, Manchester, pag 208-216
7 BERZELIUS, J. J.; Essay on the Cause of Chemical Proportions, and on Some Circumstances Relating to Them: Together with a Short and Easy Method of Expressing Them, Annals of Philosophy, Vol. 3, pag. 51-52
8 DAVY, H.; The Bakerian Lecture for 1809. On Some New Electrochemical Researches, on Various Objects, Particularly the Metallic Bodies, from the Alkalies, and Earths, and on Some Combinations of Hydrogene, Philosophical Transactions, Vol. 100, pag. 16-74