Por Carlos Vinícius Pinto dos Santos
Em tubo de ensaio pequeno, adicionar 10 gotas (0,5 mL) da amostra ou de solução padrão. Ao ocorrer precipitação com a adição de reagente precipitante, aguardar a deposição no fundo do tubo. Adicionar novamente o reagente ao sobrenadante límpido, até que não haja mais precipitação ou turvação. O sobrenadante é então separado do precipitado para as análises posteriores. É desejável que se utilize tubo de centrífuga, mesmo que a centrífuga não seja utilizada, uma vez que facilita a separação do precipitado.
Obs.: Uma vez que, durante a separação, são adicionados compostos com sódio, amônio e potássio, é fortemente recomendado investigar o Grupo V primeiro para evitar contaminações, ou reservar amostra original para realizar os devidos testes
Grupo II
(Pb+2, As+3, As+5, Sn+2, Sn+4, Sb+3, Sb+5, Cu+2, Cd+2, Hg+2, Bi+3)
O Grupo II é obtido através da precipitação com H2S em meio de HCl 0,3 M, separando-o dos demais grupos. Devido às dificuldades inerentes ao uso de gás, principalmente em se tratando de um gás corrosivo e extremamente tóxico como o sulfídrico, é utilizada a hidrólise da tioacetamida (TAA) para gerar o reagente in situ.
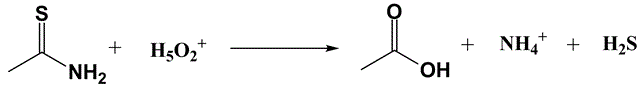
Esquema 1 - Formação de ácido sulfídrico por hidrólise da tioacetamida (TAA)
Os constituintes desse grupo possuem uma importante diferença entre si: alguns de seus sulfetos são capazes de serem ressolubilizados com excesso de sulfeto. Assim, é conveniente subdividir o grupo em duas partes: Grupo IIA (insolúveis em (NH4)2Sx) e Grupo IIB (solúveis em (NH4)2Sx).
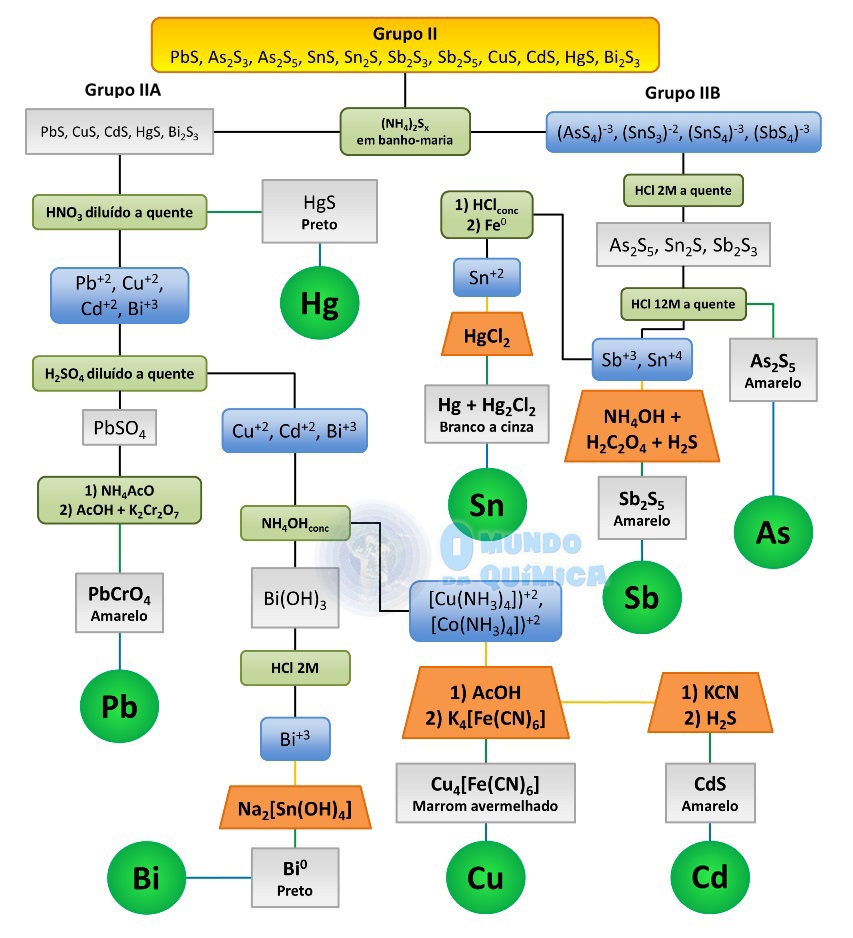
Figura 1 - Marcha de análise para o Grupo IIB
Grupo IIB - As2S3, SnS, SnS2, Sb2S3, Sb2S5
O sobrenadante da reação com polissulfeto de amônia pode conter os complexos de sulfeto de As, Sn, e/ou Sb.
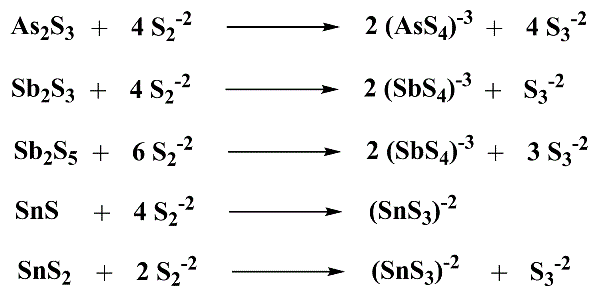
Esquema 2 - Complexos do Grupo IIB formados por excesso de sulfeto no meio
A adição de HCl diluído (2 M) a quente produz enxofre elementar (fino e de branco a amarelo, menos denso que a água) e desfaz os complexos, precipitando os sulfetos. Adicionar 5-10 mL de HCl concentrado e permitir fervura por 5 minutos. Filtrar e separar o precipitado amarelo revela presença de arsênio.
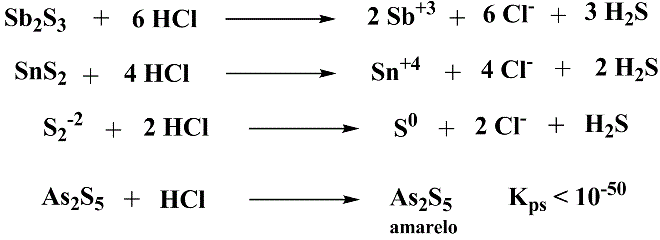
Esquema 3 - Reação dos sulfetos do Grupo IIB com ácido clorídrico
Ferver o sobrenadante para expulsar H2S residual e dividir em duas partes para investigação de estanho e antimônio.
Identificação de Arsênio
Interferentes - Cromo
Apesar de o precipitado amarelo de sulfeto de arsênio (V) ser suficiente para concluir presença de arsênio, ensaios adicionais podem ser realizados. Dissolver o precipitado em 3-4 mL de hidróxido de amônio diluído a quente e adicionar 3-4 mL de peróxido de hidrogênio 3%. Aquecer por alguns minutos e adicionar solução de nitrato de amônio, onde a formação de precipitado branco confirma a presença de arsênio. Se for adicionado nitrato de prata, o precipitado terá coloração marrom.
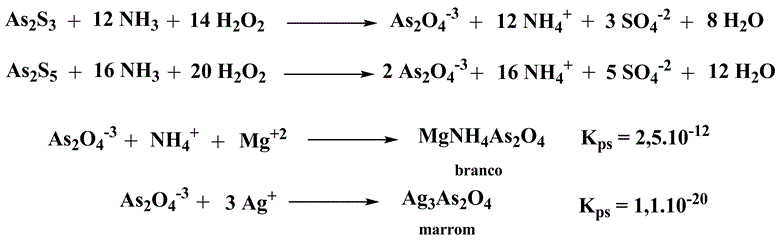
Esquema 4 - Identificação de arsênio por precipitação com prata
Identificação de Estanho
Interferentes - Não há
Neutralizar parcialmente a solução e adicionar um prego limpo em 1-2 mL de solução. Aquecer moderadamente para redução a Sn (II), filtrar e adicionar ao filtrado solução de cloreto de mercúrio (II). Ocorrência de precipitado, de branco a cinza, confirma a presença de estanho.
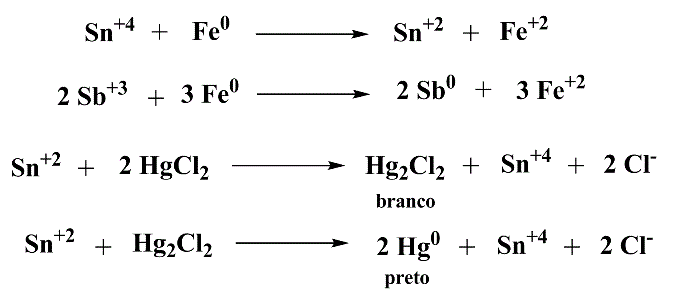
Esquema 5 - Identificação de estanho por oxidação com mercúrio (I)
Identificação de Antimônio
Interferentes - Não há
Adicionar solução diluída de hidróxido de amônio e filtrar se necessário. Adicionar 1-2 g de ácido oxálico, ferver e passar H2S à solução (CUIDADO, sempre em capela!) por 60 segundos. O aparecimento de precipitado laranja confirma a presença de antimônio.
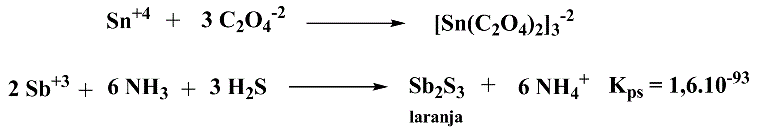
Esquema 6 - Identificação de antimônio por precipitação com sulfeto
Grupo IIA - PbS, CuS, CdS, HgS, Bi2S3
Para acessar o Grupo IIA clique aqui.
Referências
1 Adaptado da apostila de Química Analítica Qualitativa Experimental, Universidade Federal do Rio de Janeiro, 2000/2
2 Arthur I. VOGEL, Vogel's Textbook of macro and semimicro qualitative inorganic analysis, 5th Edition, Longman
3 MARTINS, C. R.; SILVA, L. A.; ANDRADE, J. B.; Sulfetos: por que nem todos são Insolúveis?, Química Nova, Vol. 33 Nº 10, pag. 2283-2286
4 SHIEK, T. J.; Screening for Inorganic Anions of Toxicological Interest, ToxTalk, Vol. 35, Nº 2, pag. 21-22
